PYCR1通過乳酸化修飾促進肝癌細胞生長和轉移
肝癌(LC)是世界上最致命的癌癥之一,現有的治療方法療效有限。本研究旨在闡明PYCR1作為LC的潛在治療靶點的作用和潛在機制。我們發現PYCR1在HCC中表達顯著升高,且這種高表達與HCC患者預后不良相關。在體內和體外,敲除或抑制PYCR1均可抑制HCC細胞的增殖、遷移和侵襲。此外,我們發現敲除或抑制PYCR1可以抑制HCC細胞中的糖酵解,減少IRS1組蛋白的H3K18乳酸化,從而抑制IRS1的表達。我們的研究結果確定PYCR1是影響腫瘤細胞代謝和基因表達的LC進展的關鍵調節因子。通過證明靶向PYCR1抑制LC細胞增殖和轉移的潛力,本研究確定PYCR1是一個有希望的LC治療靶點。本文于2024年10月發表于Clin Transl Med(IF=7.9)上。
技術路線:
結果:
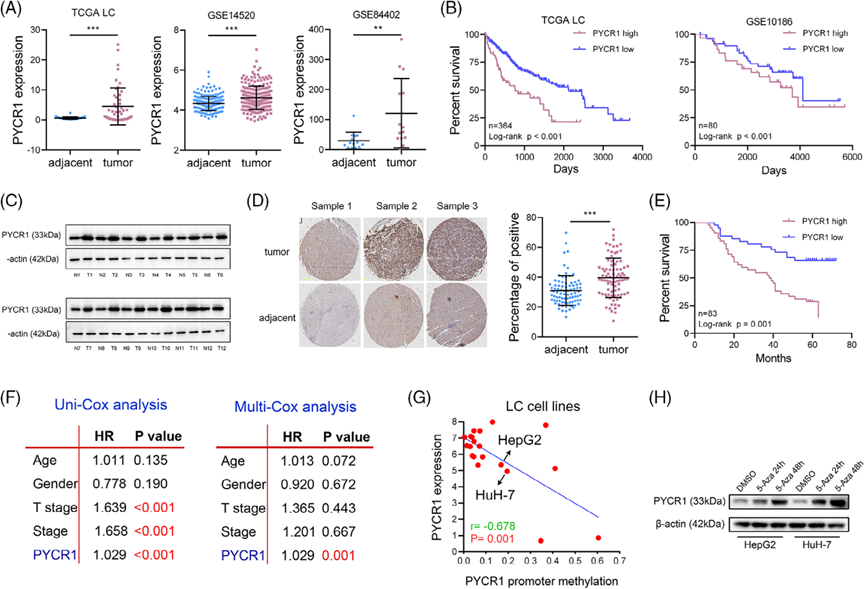
1)PYCR1在LC中表達上調,其高表達與LC患者預后不良相關
LC和癌旁組織的RNA測序數據來自TCGA和GEO數據庫的分析。結果顯示,肺癌中PYCR1 RNA水平顯著升高(圖1A)。此外,PYCR1高表達與肺癌患者預后不良顯著相關(圖1B)。通過蛋白質印跡分析驗證,肺癌組織中的PYCR1蛋白水平顯著高于癌旁組織(圖1C)。利用包含83對肺癌樣本的組織微陣列的免疫組化(IHC)結果也顯示,PYCR1在肺癌中表達顯著上調,并與肺癌患者的生存相關(圖1D、E)。隨后的Cox生存分析進一步支持了這些結果(圖1F)。PYCR1的甲基化水平與其表達水平呈負相關(圖1G)。為了驗證這一觀察結果,我們用甲基化抑制劑5-氮雜胞苷(5-AZA;10μM)處理細胞系。蛋白質印跡結果顯示,經5-AZA處理后,蛋白質水平顯著升高(圖1H)。綜上所述,PYCR1在肺癌中高表達,并與預后不良相關,其表達部分受DNA甲基化的調控。
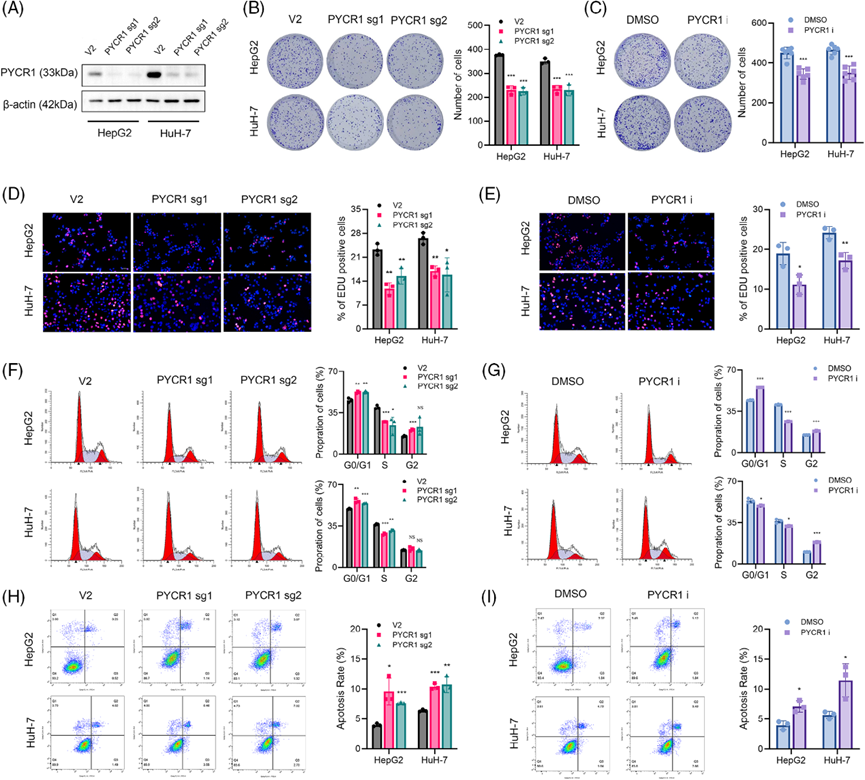
2)在體外敲除或抑制PYCR1可抑制LC細胞的生長和轉移
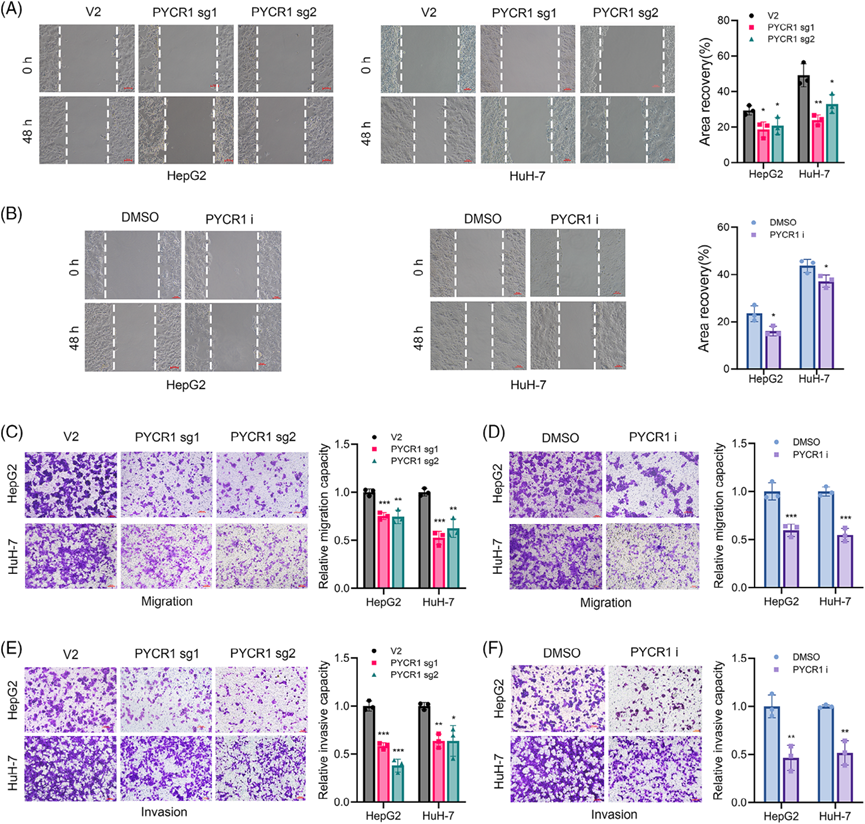
利用CRISPR-Cas9基因編輯技術構建穩定的PYCR1敲除HepG2和HuH-7細胞。Western blot驗證敲除效率(圖2A)。此外,我們在文獻中發現了一種PYCR1抑制劑,該抑制劑已在多項研究中使用,并顯示出顯著的效果。然后,我們委托該公司合成這種抑制劑,并使用穩定的敲除細胞系進行實驗,以加強我們的結果。我們測試了這種抑制劑的多個濃度,發現20 μM的濃度能顯著抑制HepG2細胞的增殖,其抑制水平與PYCR1敲除相當。為了驗證PYCR1對肺癌細胞體外的影響,我們進行了多項表型分析實驗。敲減/抑制PYCR1后,細胞形成的克隆數量顯著減少(圖2B,C)。EdU實驗的結果表明,敲除或抑制肺癌細胞中的PYCR1后,增殖細胞的比例顯著降低(圖2D,E)。此外,流式細胞術分析顯示,敲除/抑制PYCR1后,S期細胞的比例顯著減少(圖2F,G),凋亡分析顯示,敲除/抑制PYCR1后,凋亡細胞的百分比顯著增加(圖2H,I)。這些結果表明,抑制或敲除PYCR1抑制了肺癌細胞的生長。接下來,我們探索PYCR1敲除/抑制對LC細胞轉移的影響。傷口愈合實驗結果顯示,PYCR1敲除或抑制組LC細胞的遷移面積明顯小于對照組(圖3A,B)。在Transwell遷移和侵襲實驗中,敲除/抑制PYCR1后,通過腔室的細胞數量顯著減少(圖3C-F)。這些結果初步表明,敲除/抑制PYCR1可顯著降低LC細胞的轉移能力。
3)在體內敲除或抑制PYCR1會阻礙LC細胞的生長和轉移
細胞表型實驗只能證明PYCR1在體外的角色。因此,我們使用裸鼠異種移植模型和尾靜脈注射的肺癌轉移小鼠模型來探討PYCR1敲除或抑制對肺癌體內增殖和遷移/侵襲能力的影響。在使用異種移植模型時,我們觀察到敲除組腫瘤的大小顯著小于對照組,抑制劑組也觀察到了類似趨勢。此外,我們對異種移植組織進行了HE和Ki67染色。結果顯示,敲減或抑制PYCR1后,Ki67陽性細胞的比例顯著減少(圖4A,B)。在肺癌轉移模型中,PYCR1敲除組小鼠的肺轉移結節數量顯著少于對照組小鼠(圖4C)。為了進一步支持這些結果,我們從敲減和抑制劑組的肺癌細胞中提取蛋白質。然后我們通過Western blot檢測了與增殖和周期相關的蛋白、與遷移/侵襲相關的蛋白以及與凋亡相關的蛋白。結果顯示,在敲除或抑制PYCR1后,CCND1、CDK4、CDK6、N-鈣粘蛋白、波形蛋白和MMP9的表達顯著下調。相反,敲除或抑制PYCR1后,E-鈣粘蛋白和裂解的caspase 9的表達顯著上調(圖4D–G)。總結來說,這些發現支持我們之前的研究結果,并驗證了高表達的PYCR1在促進肺癌惡性進展中的作用。
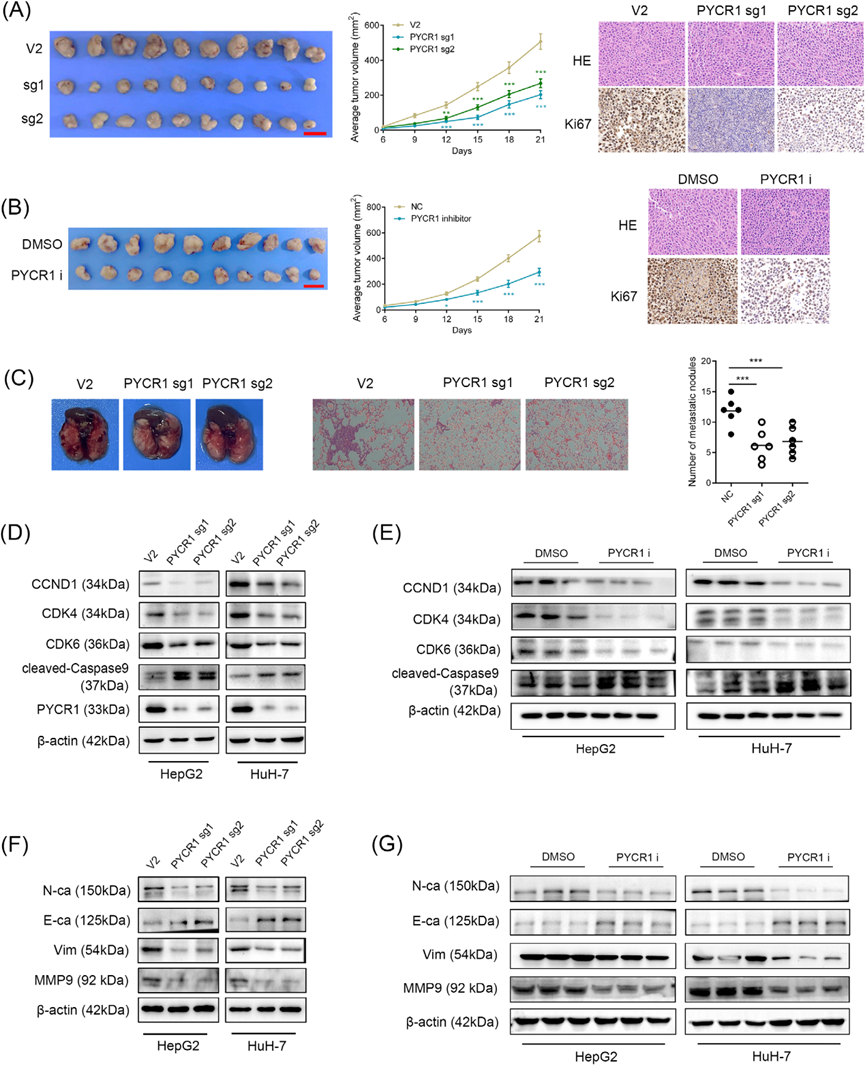
4)敲除或抑制PYCR1會干擾LC中PI3K/Akt/mTOR和MAPK/ERK通路
表型實驗表明PYCR1促進LC的惡性進展。然而,其潛在機制尚不清楚。接下來,我們使用RNA-seq鑒定HepG2細胞中PYCR1敲除后表達水平顯著改變的基因(圖5A)。途徑富集分析顯示,PYCR1敲除后表達下調的基因主要富集于間隙連接途徑、mTOR途徑和胰島素途徑,而PYCR1敲除后表達上調的基因主要富集于鐵死亡和壞死性凋亡途徑(圖5B、C)。此外,LC組織RNA-seq數據的基因集富集分析(GSEA)顯示PYCR1表達與PI3K/Akt/mTOR通路顯著正相關(圖5D)。此外,我們觀察到PYCR1表達與糖酵解代謝途徑之間存在顯著的正相關(圖5E)。我們發現PI3K/Akt/mTOR通路的上游基因IRS1在敲除PYCR1后顯著下調。此外,參與調控MAPK/ERK通路的下游基因IRS1、SOS1和SOS2在敲除PYCR1后也顯著下調。這些結果經qPCR證實(圖5F,G)。為了進一步驗證上述現象,我們從PYCR1敲除的LC細胞中提取蛋白質進行Western blot。結果顯示,PI3K/AKT/mTOR通路和MAPK/ERK通路主要蛋白水平降低(圖5H, 1)。這兩種途徑可以強烈地影響癌癥的進展,它們的聯合作用可以解釋在以前的表型實驗中觀察到的變化。
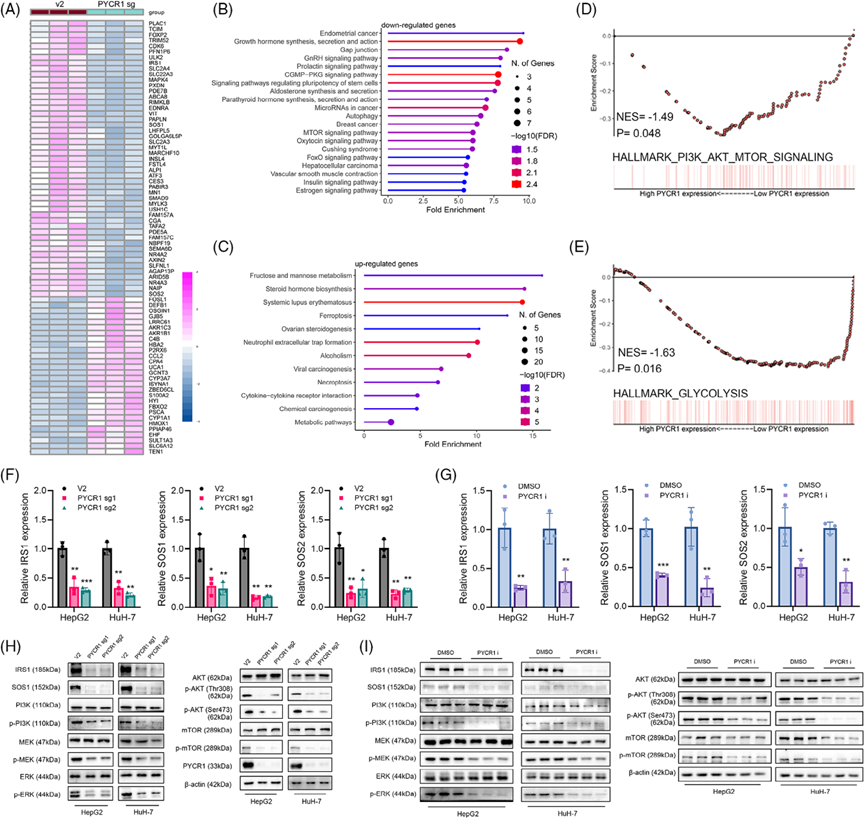
5)敲除或抑制PYCR1通過調節IRS1的表達來損害LC的進展
接下來,我們探討了PYCR1是否通過IRS1促進了LC的進展。在LC細胞中敲除PYCR1, IRS1過表達,然后將兩種處理聯合使用。集落形成和EdU染色結果表明,在PYCR1敲除細胞中,IRS1過表達后,細胞的增殖能力顯著提高(圖6A,B)。Transwell實驗證實IRS1過表達后細胞遷移和侵襲能力增加(圖6C,D)。Western blot結果顯示,在PYCR1敲除或抑制的LC細胞中,IRS1過表達后,細胞周期相關蛋白、凋亡相關蛋白和腫瘤轉移相關蛋白的表達變化被消除(圖6E)。IRS1過表達還挽救了PI3K/Akt/mTOR和MAPK/ERK通路中關鍵分子被抑制的磷酸化(圖6F)。此外,對先前動物實驗的腫瘤組織進行免疫組化,證實體內PYCR1敲低/抑制后IRS1下調(圖6G)。這些發現表明,PYCR1的敲低/抑制導致的LC進展損傷是由于IRS1的抑制。
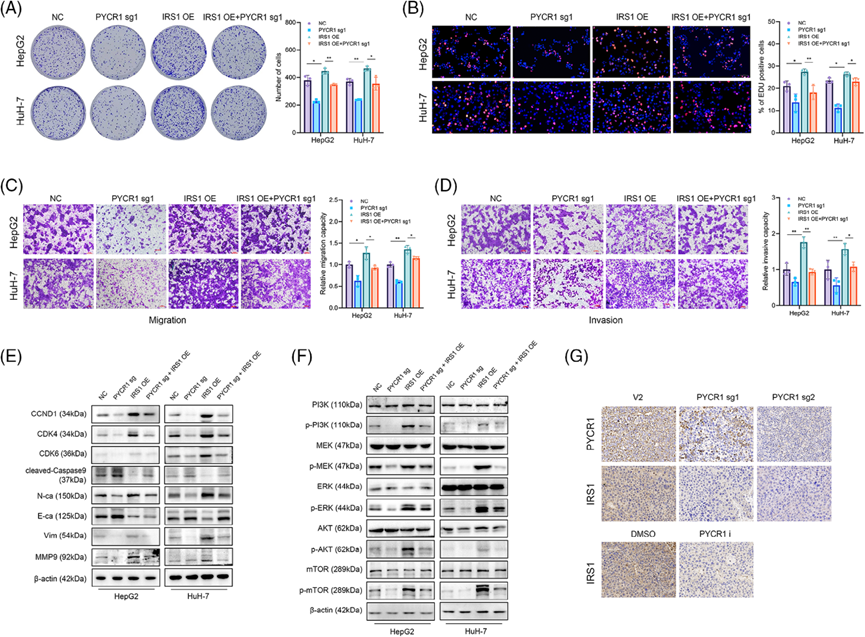
6)PYCR1通過調節IRS1啟動子區域的H3K18乳酸化來影響IRS1的表達
盡管我們確定了PYCR1通過IRS1促進肺癌進展,但這兩種分子之間的聯系機制仍然未知。PYCR1主要位于線粒體中,而IRS1位于細胞質中。這些細胞器之間沒有直接接觸,使得相互作用變得困難。我們的免疫沉淀和質譜結果也排除了這兩種分子之間相互作用的可能(結果未顯示)。我們發現PYCR1敲減組中糖酵解的代謝產物乳酸的含量顯著減少(圖7A–C)。使用生化試劑盒也觀察到了乳酸含量的顯著下降(圖7D)。最近的研究發現,乳酸可以主導蛋白質的乳酸化修飾。因此,我們假設IRS1的下調是由細胞內乳酸含量的減少引起的,進而導致組蛋白H3K18乳酸化的下調。為了驗證我們的推測,我們首先使用Western blot分析了總體蛋白質的乳酸化水平。結果顯示,當PYCR1被敲減或抑制時,總體細胞質蛋白的乳酸化水平和組蛋白H3K18位點的富集都下調了(圖7E)。然后我們進行了ChIP-PCR實驗來檢測IRS1啟動子區域的H3K18la富集情況。結果顯示,PYCR1敲除后,IRS1啟動子區域的H3K18la富集顯著減少(圖7F)。此外,IRS1啟動子熒光素酶報告基因實驗的結果顯示,響應PYCR1的IRS1轉錄活性顯著降低(圖7G)。海馬細胞代謝分析結果顯示,LC細胞中PYCR1抑制/敲低后,糖酵解程度顯著降低(圖7H)。Western blot分析證實了PYCR1敲除后葡萄糖攝取相關蛋白(GLUT2/3/4)的表達減少(圖7I)。
結論:
我們的研究揭示了PYCR1在LC中的表達模式和促瘤作用,并確定了PYCR1促進LC進展的下游靶點IRS1。此外,我們的研究表明,PYCR1可以通過組蛋白乳酸化調節LC中乳酸代謝,影響基因表達。我們的研究為尋找治療LC的新靶點提供了新的途徑。
實驗方法:
CRISPR-Cas9基因敲除,EdU,流式,傷口愈合實驗,Transwell,RNA測序,ChIP?PCR,熒光素酶報告基因實驗。
參考文獻:
Wang H, Xu M, Zhang T, Pan J, Li C, Pan B, Zhou L, Huang Y, Gao C, He M, Xue Y, Ji X, Zhang X, Wang N, Zhou H, Wang Q, Li JZ. PYCR1 promotes liver cancer cell growth and metastasis by regulating IRS1 expression through lactylation modification. Clin Transl Med. 2024 Oct;14(10):e70045. doi: 10.1002/ctm2.70045.






