基于聚集誘導發光的光動力治療誘導癌細胞鐵死亡和焦亡
光動力治療(Photodynamic therapy, PDT)是對抗耐藥性癌癥的一種有前景的治療手段。癌細胞中的脂滴在細胞代謝和信號傳導中起著關鍵作用,且與多種抗癌藥物的敏感性有關。鐵死亡是一種由脂質過氧化物積累引起的細胞死亡方式,而焦亡則是一種通過炎癥小體激活的細胞死亡方式。該研究開發一種新型的聚集誘導發光(Aggregation-induced emission, AIE)光診療劑(theranostic),它能夠特異性地定位于肝癌細胞中的脂滴,并在光照射下同時產生活性氧,以誘導癌細胞通過鐵死亡和焦亡兩種方式死亡。該文章于2024年10月發表于《Chemical Engineering Journal 》,IF=13.3。
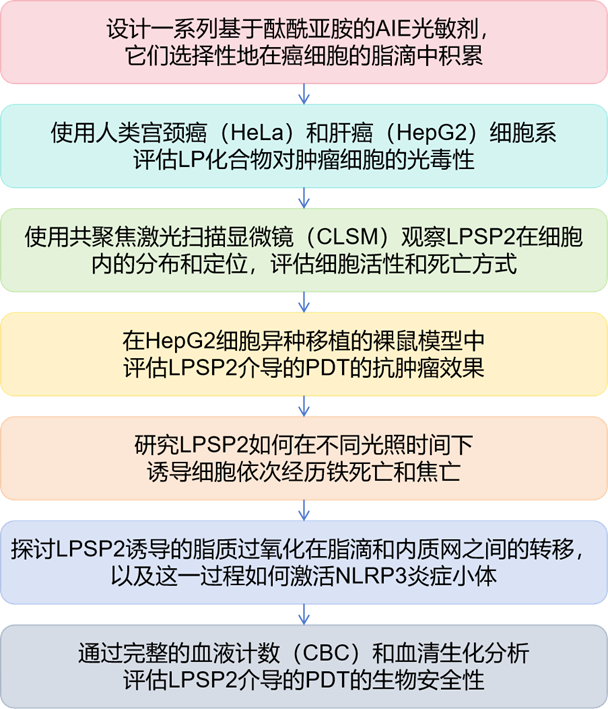
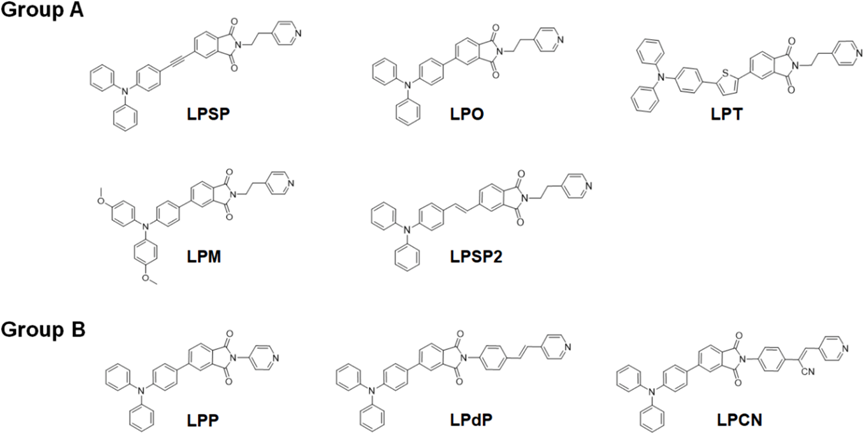
酞酰亞胺衍生物因其獨特的光物理特性和生物相容性被廣泛用作潛在的熒光團。然而,平面的酞酰亞胺環增加了π-π堆疊相互作用,從而導致在聚集狀態下猝滅。研究者設想通過簡單的結構改變,最小化有害的π-π堆疊相互作用,同時保持其光學和電化學行為。圖1顯示了這種設計的示意圖。三苯胺(TPA)基團被用作電子給體,而酞酰亞胺單元被用作電子受體。研究者采用了兩種光學改進策略:在D-A模塊之間插入各種π間隔基團(A組)和在酞酰亞胺單元的氮原子上附加另一個π共軛系統(B組)(圖2)。具有較大空間位阻的TPA預計將適應非平面的螺旋槳形狀構象,這可以防止在聚集狀態下的π-π堆疊相互作用,從而增強發射。研究者期望在TPA和酞酰亞胺之間添加π間隔基團,使AIE的π共軛更長(LPSP、LPT和LPSP2)(圖2)。還在TPA上附加了一個對二甲氧基團以增強推拉效應(LPM)。引入π間隔基團或更強的給體可以增強分子內電荷轉移(ICT)效應,并通過改善HOMO-LUMO分離來提高ISC效率,從而降低能帶間隙并增加產生ROS的能力。
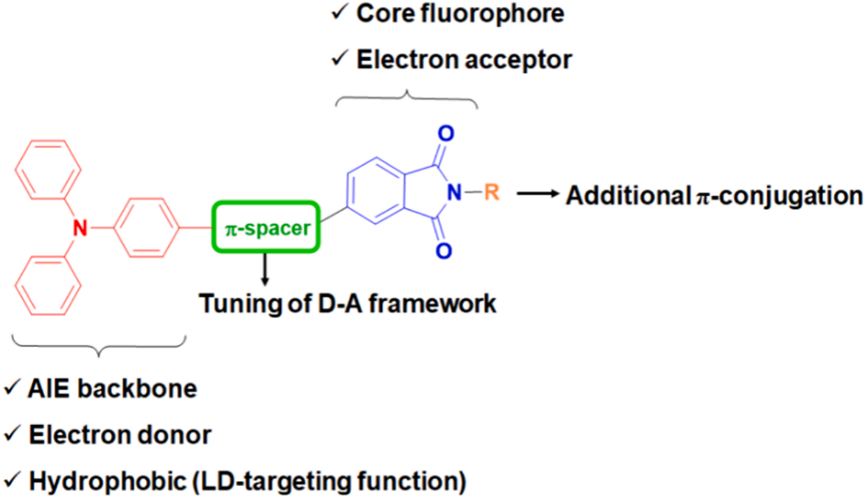
圖1. LP化合物的設計思路
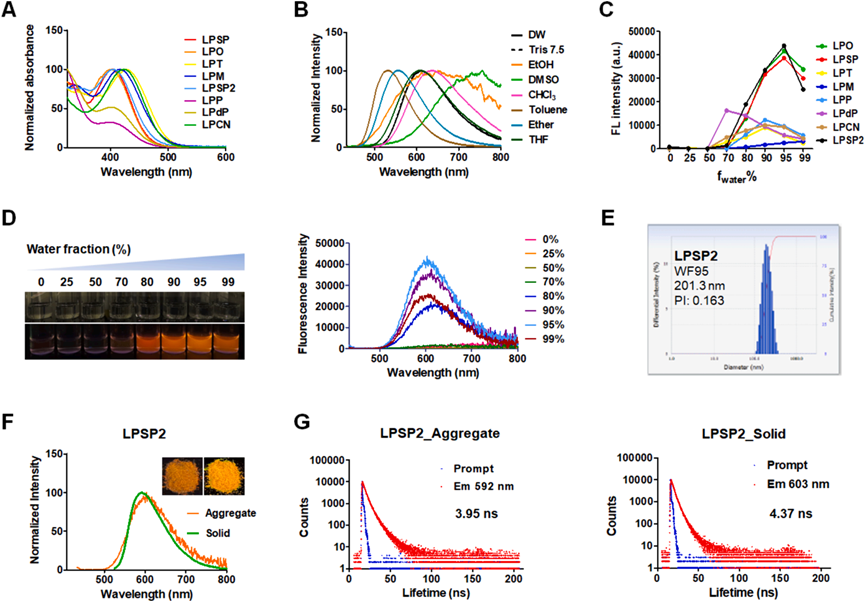
研究者評估了合成化合物的光學性質,特別是它們在不同溶劑中的發射光譜變化,揭示了分子內電荷轉移(ICT)躍遷的存在。通過調整水/乙腈溶劑系統中的水含量,觀察到LPSP、LPO和LPSP2化合物在高水含量下發射顯著增加,顯示出聚集誘導發射(AIE)特性(圖3C-D)。此外,這些化合物在水溶液中形成了適合生物成像的均勻納米顆粒。通過測量不同狀態下的熒光壽命,進一步證實了LP化合物的AIE特性,表明這些化合物在聚集和固態下具有更長的熒光壽命(圖3G)。
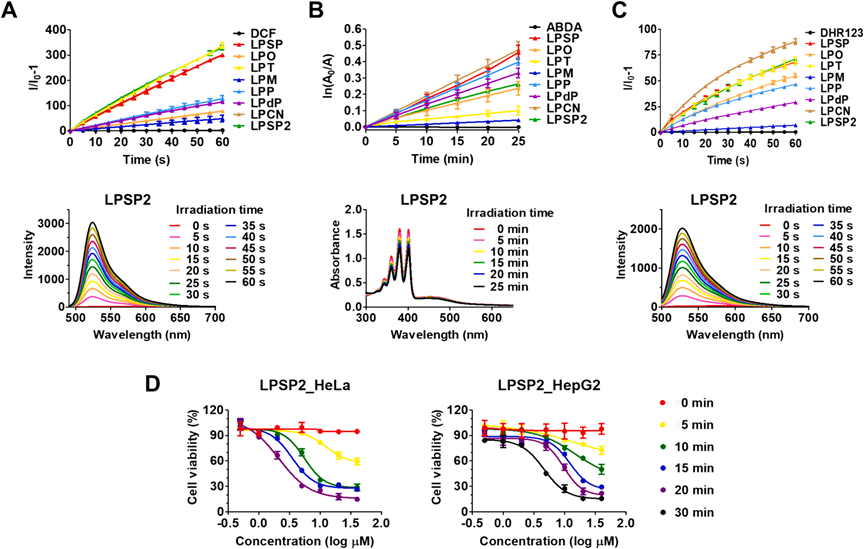
為了探究LP化合物作為光診療劑的潛力,通過H2DCF-DA、ABDA和DHR123作為指示劑共培養,測量了光誘導的ROS生成,監測了光譜的變化(圖4)。H2DCF-DA指示的ROS總量在LPSP2、LPT和LPSP中的水平明顯高于其他化合物(圖4A),表明與LPO相比,添加π間隔基團(雙鍵、噻吩或三鍵)成功增強了ROS的產生。據光學數據,與LPO相比,A組和B組都有效地展現了紅移發射。LPSP2、LPT和LPSP中額外的π間隔基團(雙鍵、噻吩環和三鍵)通過H2DCF-DA檢測到的ROS總量明顯高于其他化合物。利用LP AIEgens觀察到的ROS生成能力,使用MTT評估了體外光動力治療效率。HeLa細胞被處理與不同濃度的合成光診療劑,然后用藍色LED(900 lm/m^2)不同時間照射。在暗條件下,所有LP AIEgens的光毒性可以忽略不計;然而,在光存在的情況下,每個LP化合物的光誘導細胞毒性顯示出不同程度的PDT活性(圖4D)。
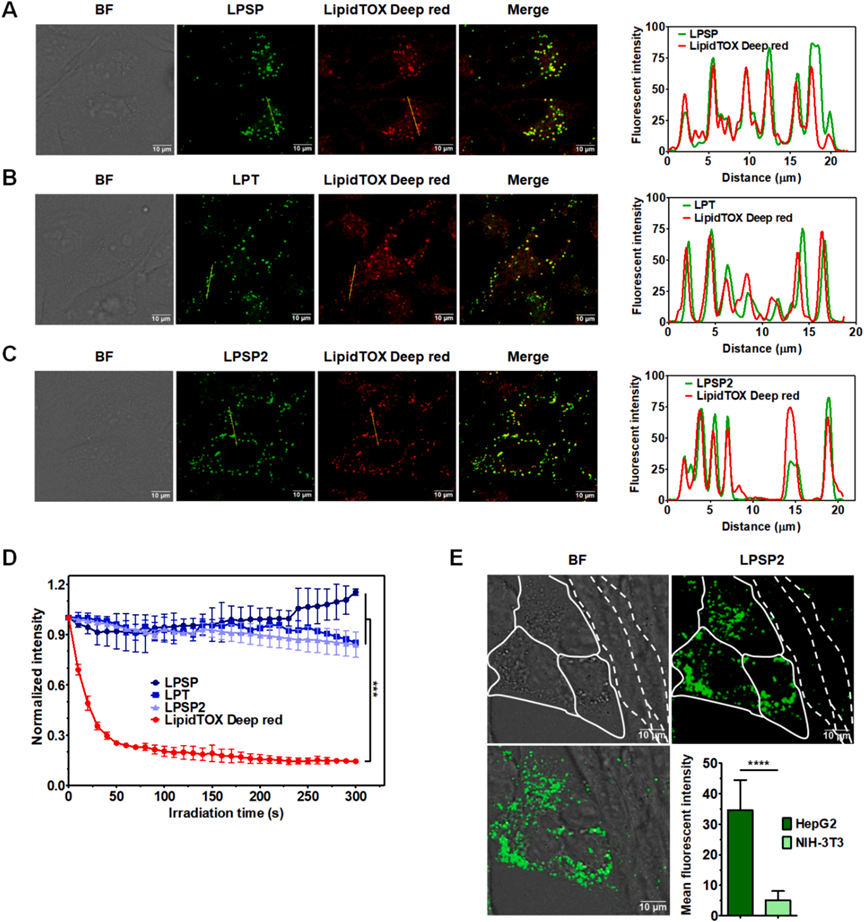
隨后,研究者使用共聚焦激光掃描顯微鏡研究了選定的AIE-PSs(LPSP、LPT和LPSP2)在活HeLa細胞中的亞細胞器靶向特性。與LipidTOX Deep Red、LysoTracker Deep Red和MitoTracker Deep Red的共定位分析表明LPSP、LPT和LPSP2選擇性地在脂滴中積累(圖5A-5C),但在溶酶體或線粒體中沒有。這些AIEgens在激光照射下的光穩定性明顯高于LipidTOX Deep Red(圖5D)。接下來,研究者評估了LPSP2對癌細胞和正常細胞的選擇性。HepG2和NIH-3T3細胞共培養并用10 μM的LPSP2染色。在HepG2細胞中觀察到明顯的熒光,而在NIH-3T3細胞中熒光可以忽略不計(圖5E)。
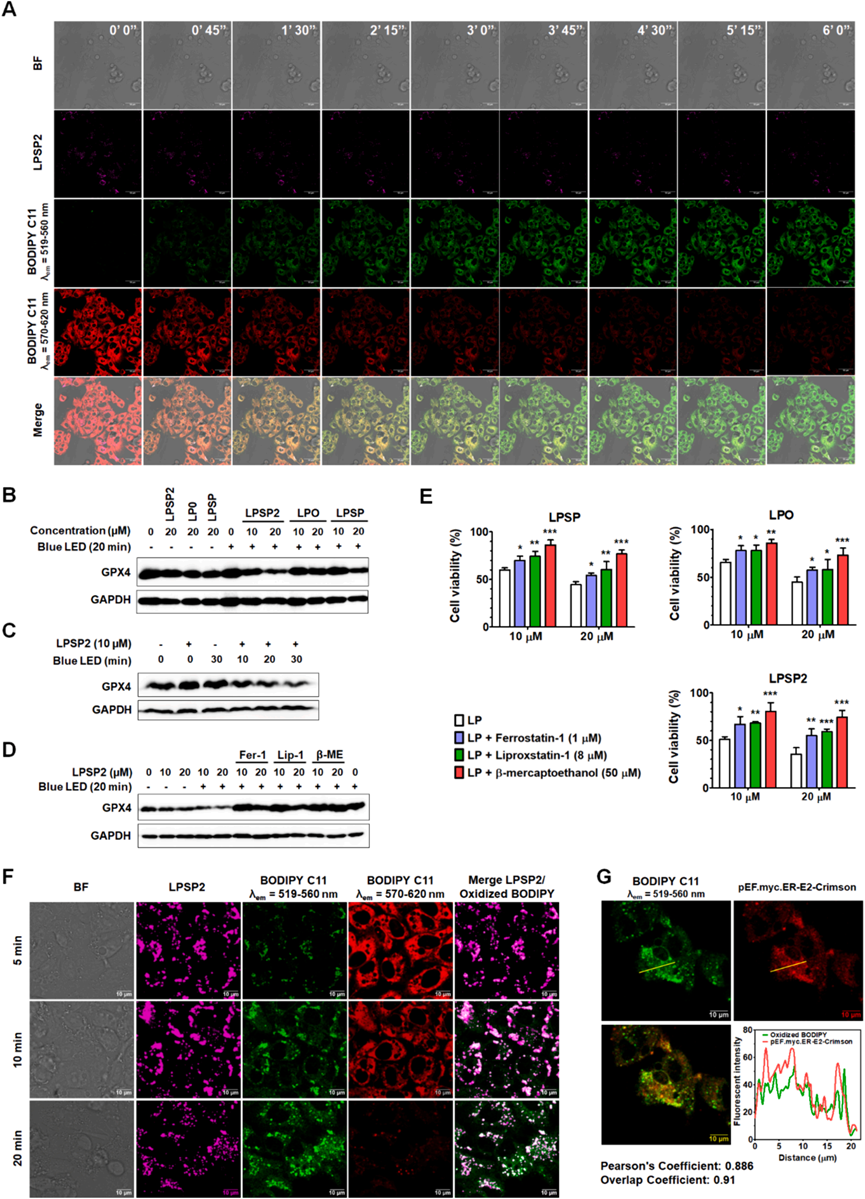
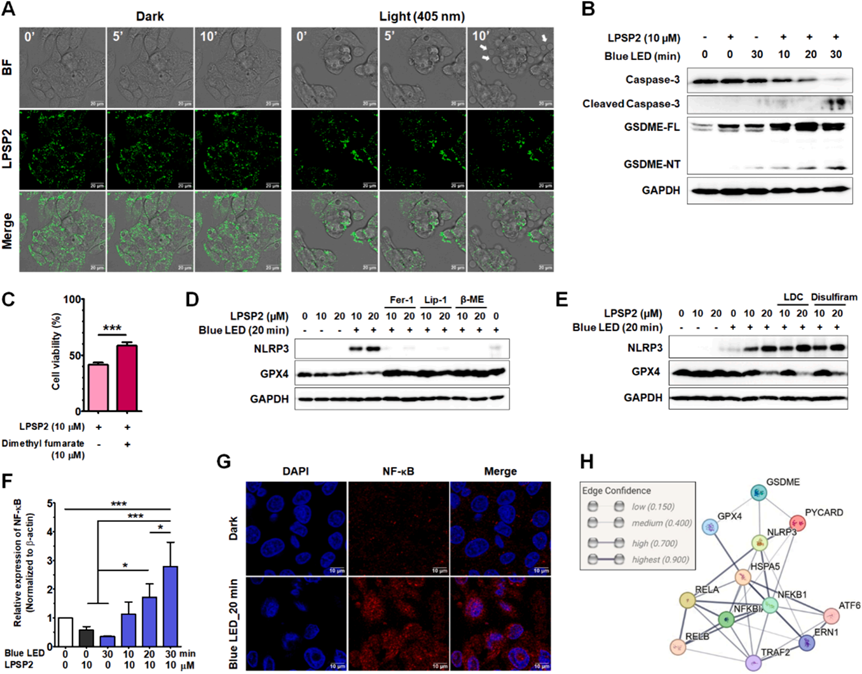
研究者還使用SOSG、DHE、HPF和BODIPY C11(圖6)測量了LPSP2在HepG2細胞中產生的ROS,結果表明在LED光照射下LPSP2在HepG2細胞中產生了I型ROS(超氧陰離子和過氧化物)。當用405nm激光照射處理LPSP2的HepG2細胞時,時間序列成像分析顯示BODIPY C11從紅色到綠色熒光的逐漸比率轉換(圖6A),表明在活細胞中產生了大量過氧化物。值得注意的是,脂質過氧化在光照射下急劇增加,與GSH-GPX4軸功能障礙后幾小時內脂質過氧化物水平的緩慢升高形成對比。隨后,研究者通過測量了GPX4水平,發現LPSP2顯著降低了GPX4水平,并依賴于光照和濃度(圖6B-C)。此外,使用鐵死亡抑制劑Fer-1、Lip-1和β-巰基乙醇(圖6D-E)的情況下,GPX4水平以及細胞活性恢復。因此,脂質ROS的積累與細胞中GPX4的降低有關,表明LPSP2誘導的鐵死亡細胞死亡。
如圖6F所示,BODIPY C11與LPSP2共定位明顯,表明在LPSP2處理和光照射下在脂滴中形成了脂質過氧化物。此外,長時間照射的細胞顯示出更多的氧化BODIPY C11的綠色信號,這些信號圍繞著脂滴(圖6F)。為了弄清LPSP2在HepG2細胞中產生的脂質過氧化物的位置,研究者使用MitoTracker Deep Red和ER Tracker Blue-White與BODIPY C11共染,LPSP2在20分鐘照射后產生的脂質過氧化物并沒有在線粒體中積累,而是主要定位在ER室。通過轉染HepG2細胞與表達ER蛋白的pEF.myc.ER-E2-Crimson(圖6G)也證實了與ER的共定位。這些結果表明,脂質過氧化物主要是在短時間照射時在脂滴中產生和檢測到的,而隨著照射時間的延長,它們轉移到ER中,引發HepG2細胞的ER應激。
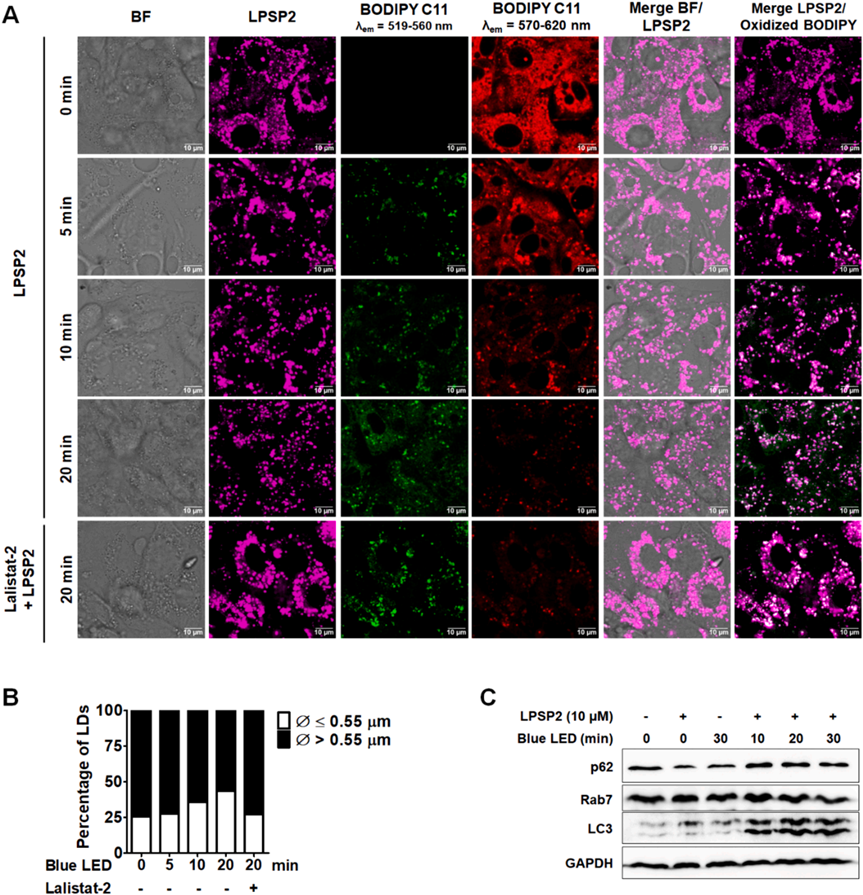
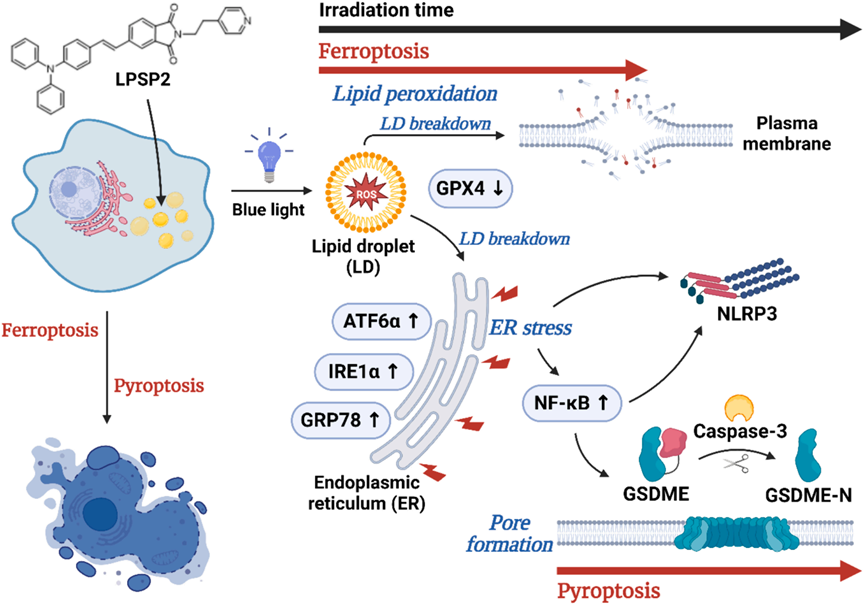
活細胞共聚焦成像顯示,與短時間照射的細胞相比,LPSP2處理的細胞在20分鐘照射的細胞中脂滴數量顯著增加(圖7A)。大脂滴的百分比以照射時間依賴的方式減少(圖7B)。阻斷自噬和細胞質脂解的情況下,20分鐘照射樣本中的大脂滴數量顯著增加(圖7B)。統計分析顯示,在這些條件下脂滴的大小有顯著差異(p < 0.001)。此外,與未處理樣本相比,用lalista-2處理的樣本中圍繞脂滴的氧化BODIPY C11的信號顯著降低,表明lalista-2阻斷了脂質過氧化物向ER的運輸(圖7A)。在用LPSP2和藍色LED光照射處理后,LC3-II/LC3-I的比例逐漸增加(圖7C),反映了在光條件下脂滴周圍自噬體的形成。此外,在長時間照射的細胞中也表明了Rab7介導的脂滴自噬。研究者用LPSP2的共聚焦活細胞成像的發現與wb一致,表明在光動力治療下,脂滴通過脂解和脂滴自噬分解,增加了HepG2細胞中多不飽和脂肪酸(PUFAs)的脂質過氧化水平,有助于鐵死亡。以上實驗結果揭示了在脂滴中產生的脂質過氧化物在ER中積累,表明脂滴分解途徑有助于調節鐵死亡的敏感性。
研究者發現用405nm單色光或藍色LED光長時間照射后LP處理的細胞后,細胞中出現小泡(圖8A)。為了監測細胞膜的變化,研究者對HepG2細胞膜進行染色后進行活細胞觀察。在光照前細胞膜是完整的,而脂滴與細胞膜之間的接觸部位在PDT治療后顯示出細胞膜逐漸破裂,提示脂滴中的氧化脂質可能通過接觸釋放到完整的細胞膜上,導致細胞膜損傷。同時,如圖8B所示,HepG2細胞在照射后激活Caspase-3和焦亡標志物GSDM-E。在焦亡抑制劑存在下,細胞活性顯著恢復(圖8C)。鐵死亡以及其他類型的調節性壞死,包括壞死和焦亡通過激活NLRP3炎癥體促進炎癥。如圖8D-E所示,在照射樣本中NLRP3的表達水平顯著增加,而在鐵死亡抑制劑(圖8D)處理后幾乎檢測不到。相反,在補充有焦亡抑制劑的細胞中(圖8E),NLRP3炎癥體的水平保持較高,表明在使用LPSP2的PDT早期發生了鐵死亡,在NLRP3激活之前,并且在長時間炎癥后轉移到了另一種細胞死亡途徑。在PDT期間順序激活鐵死亡和焦亡尚未有報道。
由于線粒體損傷是NLRP3途徑激活研究最廣泛的刺激因素,研究者使用TMRE染料來檢查線粒體膜電位,排除了去極化線粒體是LPSP2處理的HepG2細胞中NLRP3激活的原因。相反,脂滴和ER中脂質過氧化物的積累不可避免地導致ER中的氧化應激,從而激活NLRP3。
為了驗證ER應激在NLRP3激活中的作用,研究者評估LPSP2在PDT條件下未折疊蛋白反應的激活,ATF6α、IRE1α和GRP78顯著增加。先前的研究表明ER應激、NLRP3炎癥體激活和肝細胞死亡之間的關聯。并且ER應激可以通過氧化應激、鈣穩態和NF-κB激活來激活NLRP3炎癥體。用LPSP2處理的HepG2細胞中NF-κB的表達也隨著照射時間的增加而顯著增加(圖8F),以及NF-κB的核轉位(圖8G)。PPI分析展示了ATF6α、NF-κB和NLRP3之間的相互關系(圖8H),表明在LPSP2光照射處理的細胞中ER應激、NF-κB和NLRP3炎癥體激活之間復雜的相互作用。研究揭示了LPSP2誘導HepG2細胞發生鐵死亡,然后通過ER應激和NF-κB信號傳導轉移到焦亡(圖9)。
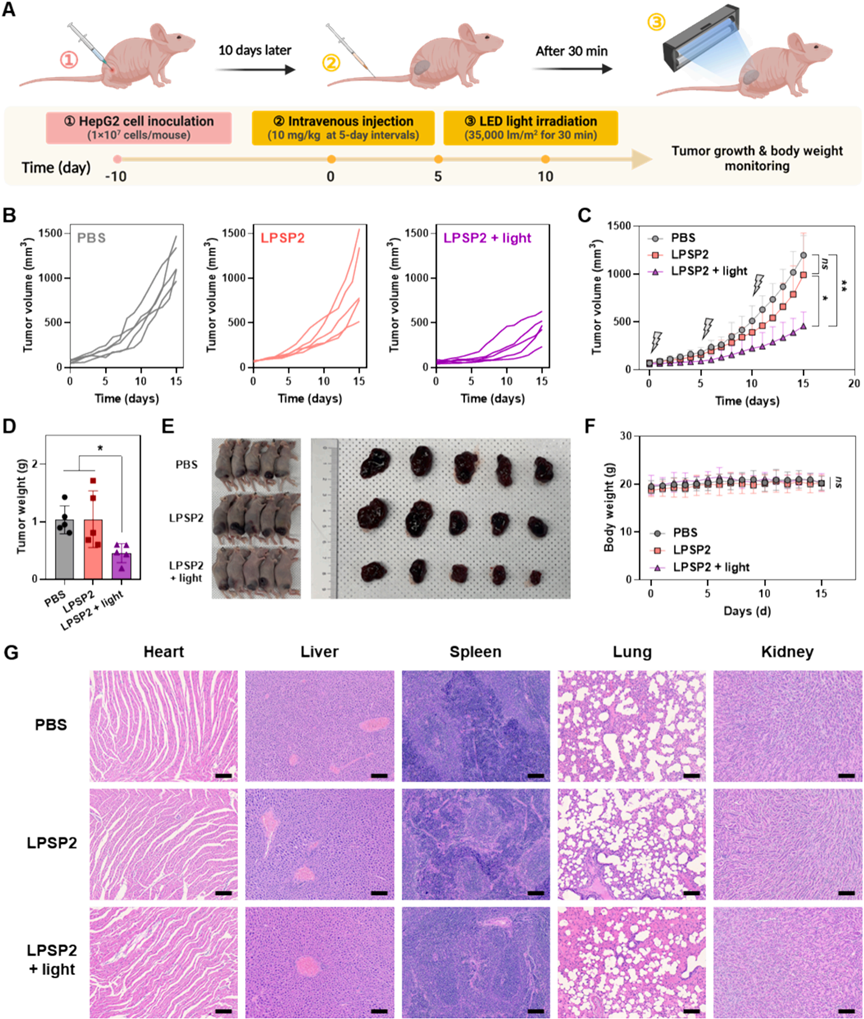
為評估LPSP2介導的光動力治療的抗腫瘤療效,研究者構建了HepG2細胞異體移植BALB/c裸鼠模型(圖10A)。相比于對照組和LPSP2單獨處理組,LPSP2結合光照治療顯著抑制了腫瘤生長(圖10B-E)。而各組之間小鼠的體重沒有明顯差別(圖10F),HE染色結果表明治療沒有引起小鼠器官病變(圖10G),表明LPSP2介導的光動力治療沒有明顯不良影響。為進一步評估LPSP2介導的光動力治療的生物安全性,研究者對模型小鼠進行血液計數和血清生化分析,三個組別之間并未發現明顯差異.以上結果證明,LPSP2與光照射相結合,有效抑制HepG2腫瘤模型中腫瘤生長,而不會誘導全身毒性,提示其癌癥治療的潛力。
研究者通過AIE光診療劑實現了對脂質過氧化的時空控制,AIE光診療劑介導的光動力治療能夠順序誘導肝癌細胞發生鐵死亡和焦亡顯示出顯著的抗腫瘤效果,且沒有引起明顯的系統毒性。靶向脂滴的AIE光診療劑為癌癥治療策略提供了新的見解。
實驗方法
設計和合成AIE光診療劑、qRT-PCR、MTT實驗、共聚焦激光掃描顯微鏡、熒光探針檢測細胞內活性氧、時間序列成像技術、線粒體膜電位檢測、細胞培養和轉染、腫瘤細胞異種移植的裸鼠模型、HE染色、血液計數和血清生化分析
Le Bich Hang Pham, Khanh Linh Chung, So-Yeol Yoo, Seoyoung Kim, Bumhee Lim, Jae-Young Lee, Jeeyeon Lee, Sequential induction of ferroptosis and pyroptosis in cancer cells by lipid droplet-targeting AIE theranostics, Chemical Engineering Journal, Volume 498, 2024, 155439, https://doi.org/10.1016/j.cej.2024.155439.






