從脂肪干細(xì)胞到乳腺癌細(xì)胞的線粒體轉(zhuǎn)移驅(qū)動(dòng)多重耐藥
乳腺癌(BC)是一種復(fù)雜的疾病,在遺傳背景、分子亞型和治療方法上都表現(xiàn)出異質(zhì)性。以往的治療策略一直針對癌細(xì)胞,但這些不是腫瘤體積的獨(dú)特組成部分,其中腫瘤微環(huán)境(TME)起著關(guān)鍵作用,對其更好的理解對于獲得更好的結(jié)果至關(guān)重要。作者通過MitoTracker實(shí)驗(yàn)、Mitoception、共聚焦和免疫熒光分析,評估了脂肪干細(xì)胞與不同乳腺癌細(xì)胞(BCCs)共培養(yǎng)的線粒體轉(zhuǎn)移(MT)。MT抑制劑用于隧道納米管(TNTs)的MT確認(rèn)。采用多柔比星法和ABC轉(zhuǎn)運(yùn)蛋白法評價(jià)MT對耐多藥(MDR)的影響。此外,通過耗氧率(OCR)和免疫印跡分析來測量ATP的產(chǎn)生。作者發(fā)現(xiàn)MT通過隧道納米管(TNTs)發(fā)生,可以被肌動(dòng)蛋白聚合抑制劑阻斷。此外,在ASCs和患者來源的類器官之間的雜交共培養(yǎng)中,作者發(fā)現(xiàn)了大量MT。具有ASCs來源的線粒體(ADM)的乳腺癌細(xì)胞(BCCs)在缺氧條件下顯示HIF-1α表達(dá)降低,ATP產(chǎn)生增加驅(qū)動(dòng)ABC轉(zhuǎn)運(yùn)體介導(dǎo)的多藥耐藥(MDR),與氧化磷酸化代謝重新連接有關(guān)。作者提供了從脂肪干細(xì)胞(ASCs)到BC模型的線粒體轉(zhuǎn)移(MT)發(fā)生的概念證明。阻斷從ASCs到BCCs的MT可能是BC治療的一種新的有效治療策略。該文章于2024年6月發(fā)表在《Journal of experimental & clinical cancer research》,IF:11.4。

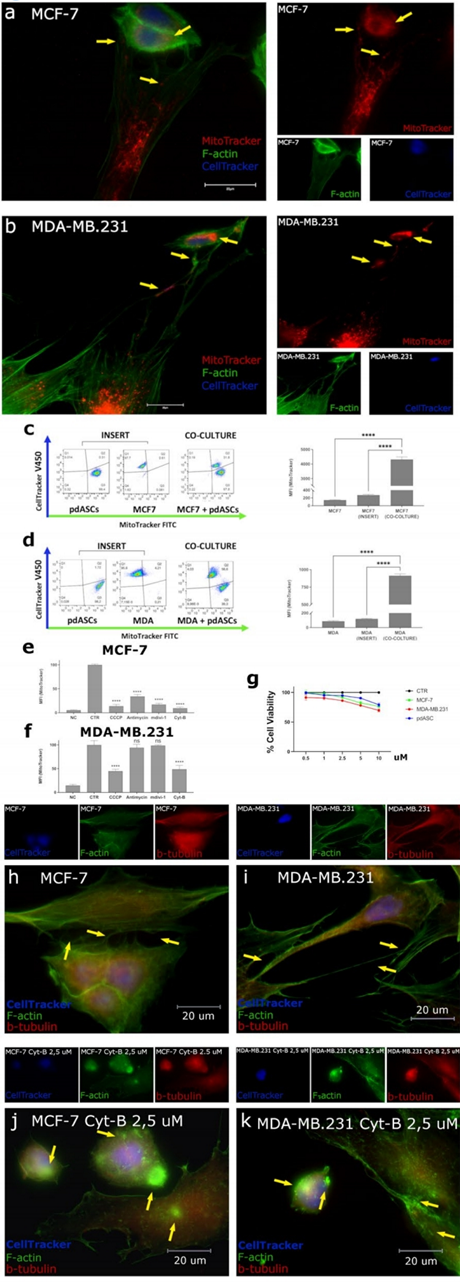
將pdASCs與luminal MCF7和三陰性MDA-MB.231共培養(yǎng),評估MT。pdASCs從人脂肪組織中分離出來,作者發(fā)現(xiàn)pdASCs線粒體通過一個(gè)復(fù)雜的tnt通訊網(wǎng)絡(luò)轉(zhuǎn)移到BCCs。這些是pdASCs支架的細(xì)胞膜突起,f-肌動(dòng)蛋白和β-微管蛋白陽性,整個(gè)長度上線粒體非常豐富。通過這些結(jié)構(gòu),pdASCs將其預(yù)標(biāo)記的(MitoTracker-FITC/PE)線粒體運(yùn)輸?shù)筋A(yù)標(biāo)記的(CellTracker-DAPI) BCCs。在MCF-7(圖1a)和MDA-MB.231中觀察到外源性預(yù)標(biāo)記線粒體(圖1b),共培養(yǎng)24 h后(圖1a-b黃色箭頭),并通過FACS分析進(jìn)行量化(圖1c-d)。當(dāng)細(xì)胞被多孔細(xì)胞培養(yǎng)插入物物理分離時(shí),MT不會發(fā)生(圖1c-d)。
隨后,為了探索抑制MT的方法,作者用(i)羰基氰化物間氯苯基肼(CCCP 5μM)或(ii)Anti-Ycin- A(0.1μM),兩種不同的線粒體呼吸抑制劑,(iii)線粒體分裂抑制劑-1(MdiVi-1 10μM),抑制Drp1,以及(iv)細(xì)胞松弛素B(Cyt-B 2.5μM),一種肌動(dòng)蛋白聚合抑制劑來處理兩種共培養(yǎng)模型。作者發(fā)現(xiàn)MdiVi-1和anti - ycin- a顯著降低MCF-7中的MT。此外,CCCP抑制MT,但MCF-7(%MFI = 13.6%)的作用比MDA-MB.231更為明顯(%MFI = 44.7%)(圖1-f)。此外,肌動(dòng)蛋白聚合抑制劑Cyt-B在亞致死劑量下阻斷MT(圖1g),盡管MCF-7更敏感(%MFI分別= 9.5%和48.7%)。
Cyt-B非常有效地抑制了TNTs支架(圖1h-k),對細(xì)胞形態(tài)產(chǎn)生了巨大影響。確實(shí),檢測到細(xì)胞結(jié)構(gòu)塌陷,外觀更小,形狀更圓,許多膜內(nèi)陷,細(xì)胞質(zhì)中積累了F-actin聚集體(圖1j-k)。因此,細(xì)胞不能支撐基于肌動(dòng)蛋白的TNTs不能相互接觸,這阻礙了MT。
作者證實(shí)了MT也發(fā)生在pdASCs和患者源性乳腺癌模型BCAHC-1和BCC-66之間。有趣的是,作者觀察到pdASCs和原代BCAHC-1細(xì)胞之間形成了TNTs,線粒體通過TNTs被輸送到BCAHC-1細(xì)胞(圖2a,黃色箭頭);FACS分析也證實(shí)了這一機(jī)制(圖2b)。此外,在亞致死劑量下,CCCP 5 μM顯著降低了MT率,而Cyt-B(%MFI = 27.2%)的MT率更低(圖2c-d)。值得注意的是,如前所述,Cyt-B阻斷了由F-actin和β-Tubulin組成的tnt支架(圖2e-f,黃色箭頭)。這些深刻的形態(tài)學(xué)變化影響了細(xì)胞間的接觸,顯著降低了MT。
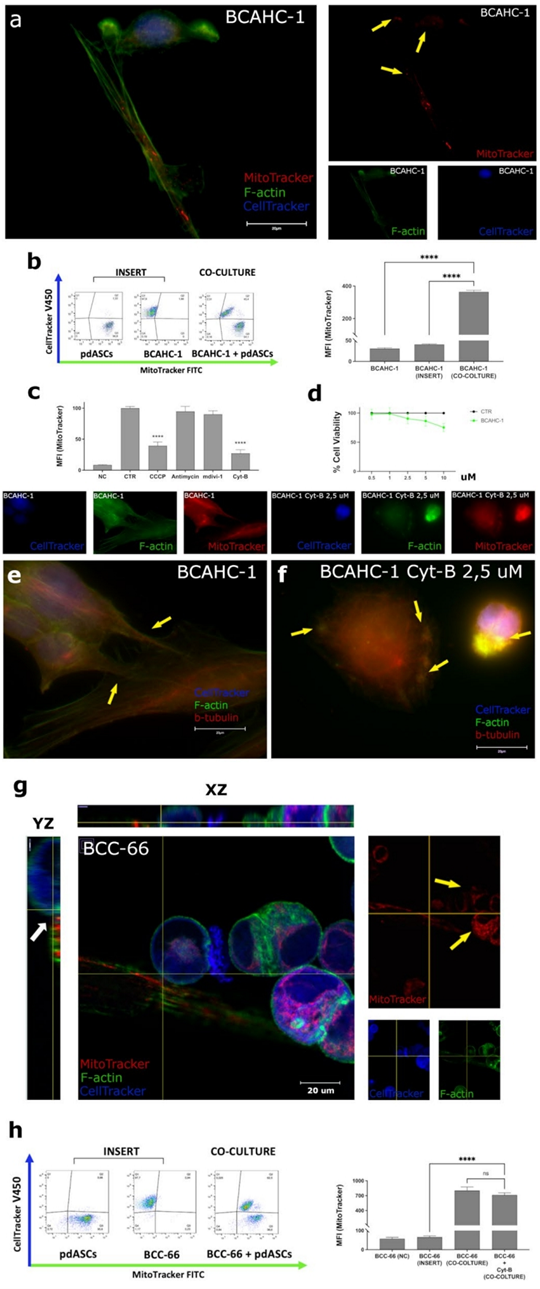
此外,作者研究了從一個(gè)腔內(nèi)乳腺癌患者分離的BCC-66 PDOs的MT。作者初步發(fā)現(xiàn)BCC-66與原始患者組織具有相同的基因組圖譜。根據(jù)作者之前的研究結(jié)果,作者在BME中分離的BCC-66和pdASCs之間建立了混合的2D/3D共培養(yǎng)。BCC-66能夠接觸到pdASCs,并從中大量獲取線粒體(圖2,黃色箭頭),盡管作者沒有捕獲到tnt的形成。三維正交z疊圖像重建證實(shí),黏附的pdASCs直接接觸懸液中的BCC-66(圖2g,白色箭頭)。流式細(xì)胞儀證實(shí)MT,但僅在細(xì)胞之間物理接觸的情況下。相反,Cyt-B 2μM沒有顯著抑制MT(圖2h),表明在這種2d /3D雜交共培養(yǎng)中,依賴于物理接觸的其他機(jī)制可能介導(dǎo)MT。
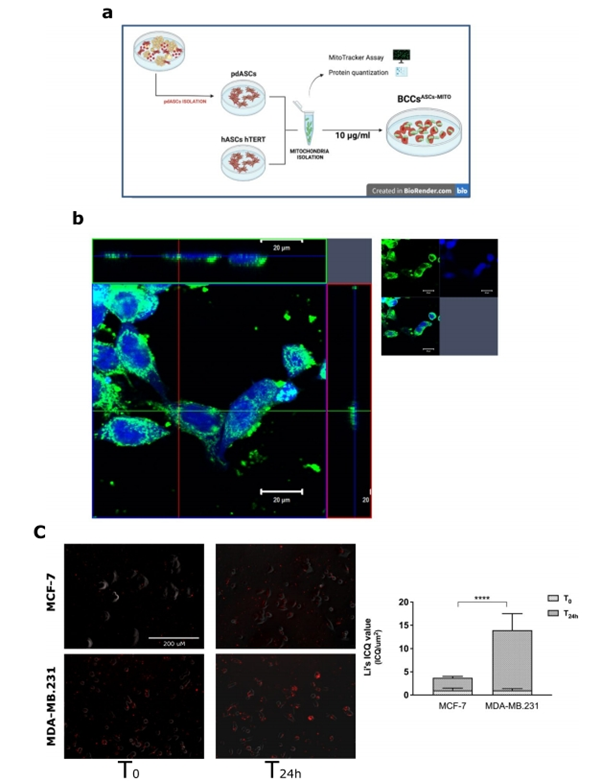
為了更好地區(qū)分轉(zhuǎn)移到BCCs的外源線粒體的選擇性作用,作者采用了MitoCeption(MCP),這是一種用于迫使線粒體內(nèi)化的程序,來自供體細(xì)胞進(jìn)入受體細(xì)胞,功能上吞噬并保留它們在其細(xì)胞質(zhì)中。根據(jù)Caicedo等人的研究,作者從pdASCs和hTERT永生化hASCs中分離并鑒定了線粒體;然后作者將它們轉(zhuǎn)移到MCF-7或MDA-MB。231個(gè)細(xì)胞(圖3a)。24h后,通過共聚焦圖像的z疊正交視圖重建驗(yàn)證MCP。在這里,作者鑒定了pdASC預(yù)標(biāo)記的線粒體(MitoTracker-red)在BCCs的細(xì)胞質(zhì)中有空間分布(CellTracker-DAPI)(圖3b)。通過統(tǒng)計(jì)分析轉(zhuǎn)移的pdASCs線粒體與受體細(xì)胞之間的共定位,評估MCP效率,驗(yàn)證線粒體內(nèi)化(圖3c)。在24h(T24h)后,線粒體與細(xì)胞共定位,如非隨機(jī)空間相關(guān)性分析所示。此外,MDA-MB.231明顯比MCF-7更能攝取外源線粒體(圖3c)。綜上所述,作者的研究結(jié)果表明,MCP可以提高線粒體攝取的效率,MDA-MB.231比MCF-7獲得更多的線粒體。
為了從功能上表征MT效應(yīng),作者研究了不同化療藥物對攜帶外源性線粒體的BCCs的抗腫瘤活性。考慮到MCP顯著下調(diào)受體BCCs中HIF-1α蛋白的表達(dá)(圖4a),作者決定在實(shí)驗(yàn)中采用這一條件。功能上,ASCs來源的線粒體(ADM)在24小時(shí)后顯著降低了CIS(10μM)和DTX(50 nM)在兩個(gè)BCC細(xì)胞系中的細(xì)胞毒性(圖4b-c)。具體而言,ADM對MCF-7具有細(xì)胞保護(hù)作用,對CIS(> 15%)和DTX(> 11%)和缺氧(CIS > 33%)(圖4b)。類似地,ADM保護(hù)MDA-MB。231例來自CIS(> 15%),缺氧時(shí)效果較輕(圖4c)。dtx誘導(dǎo)的細(xì)胞毒性也有同樣顯著的結(jié)果,缺氧時(shí)的細(xì)胞毒性更強(qiáng)(60%)。有趣的是,攜帶adm的MCF-7獲得DTX抗性是由于它們調(diào)節(jié)凋亡機(jī)制的能力,而作者沒有觀察到CIS處理后對該機(jī)制的調(diào)節(jié)有顯著差異(圖4d)。相反,在缺氧條件下,ADM對兩種藥物的細(xì)胞保護(hù)作用都非常強(qiáng)。作者在攜帶adm的MDA-MB.231中也發(fā)現(xiàn)了同樣的效果(圖4 e)。在這里,DTX強(qiáng)烈促進(jìn)細(xì)胞凋亡,即使在缺氧情況下,adm介導(dǎo)的這一現(xiàn)象的顯著逆轉(zhuǎn)。綜上所述,作者的研究結(jié)果表明,在缺氧和常氧條件下,ADM增加了BCCs的MDR,阻止了細(xì)胞凋亡的誘導(dǎo)。
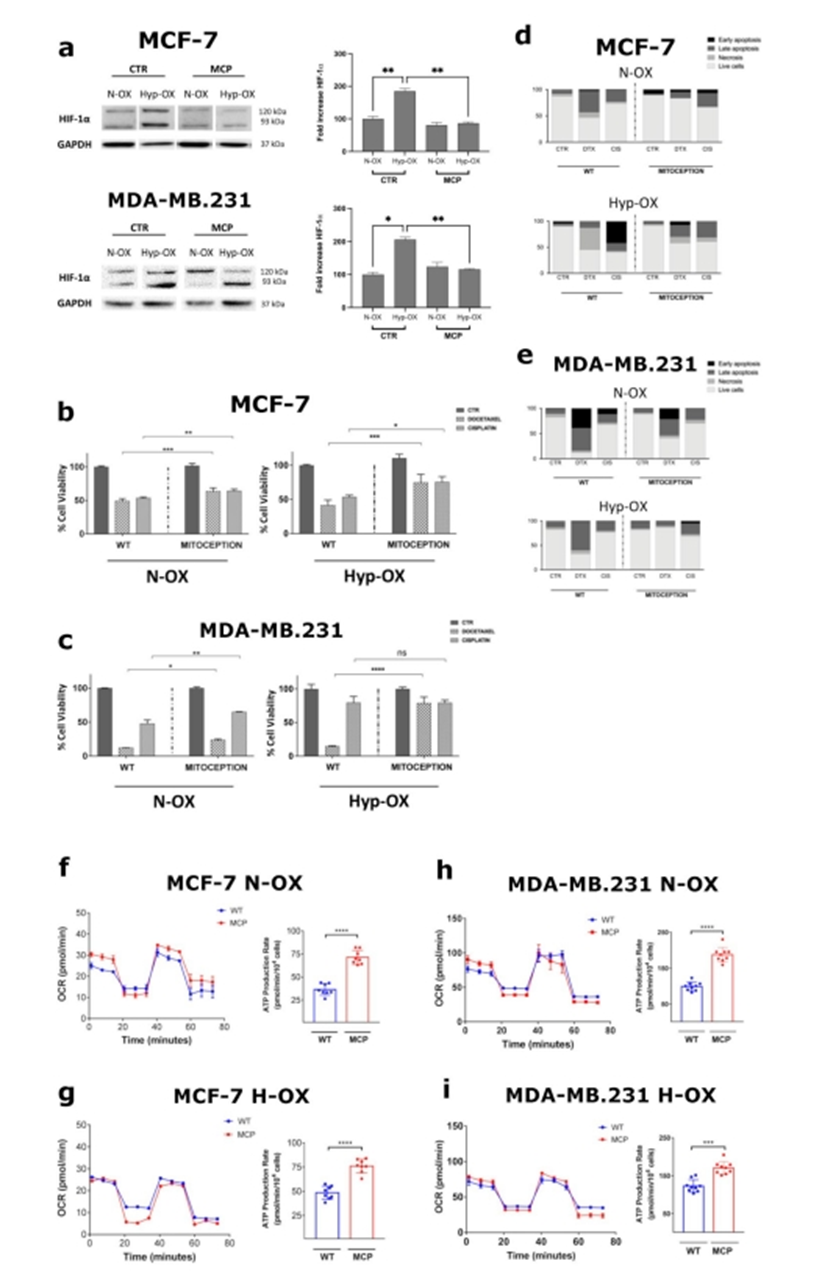
由于線粒體在能量穩(wěn)態(tài)中起著關(guān)鍵作用,作者通過胞外通量分析評估了ADM對BCCs代謝的影響。在這里,ADM強(qiáng)烈上調(diào)ATP速率產(chǎn)生,與線粒體呼吸有關(guān)(ΔATP)。事實(shí)上,在攜帶ADM的MCF-7中,作者發(fā)現(xiàn)基礎(chǔ)呼吸(OCR > 18%)和最大呼吸(OCR > 10%)顯著增加,ATP生成速率相對增加(ΔATP > 35 pmol/min)(圖4f)。此外,作者發(fā)現(xiàn)備用呼吸顯著減少(OCR < 18%),主要是由于ADM介導(dǎo)的基礎(chǔ)耗氧速率增加。相反,在缺氧情況下,ADM對基礎(chǔ)呼吸和最大呼吸沒有顯著影響,但總耗氧能力提高,導(dǎo)致ATP產(chǎn)量相應(yīng)增加(ΔATP > 27 pmol/min)(圖4)。在MDA-MB.231 ADM對線粒體代謝的影響非常相似。在這些細(xì)胞中,MCP后基礎(chǔ)呼吸顯著增加(OCR為12%),而最大呼吸無顯著差異(圖4h)。即使在這種情況下,由于基礎(chǔ)耗氧量增加,ADM顯著降低了備用呼吸(OCR < 18%),導(dǎo)致ATP生成速率加倍(ΔATP > 90 pmol/min)。在缺氧MDA-MB.231 MCP后呼吸量和基礎(chǔ)呼吸無明顯變化(圖4i)。然而,這兩個(gè)參數(shù)都增加了(OCR > 12%),顯著提高了ATP生成速率(ΔATP > 47 pmol/min)。綜上所述,作者的結(jié)果表明,ADM導(dǎo)致ATP的產(chǎn)生增加。
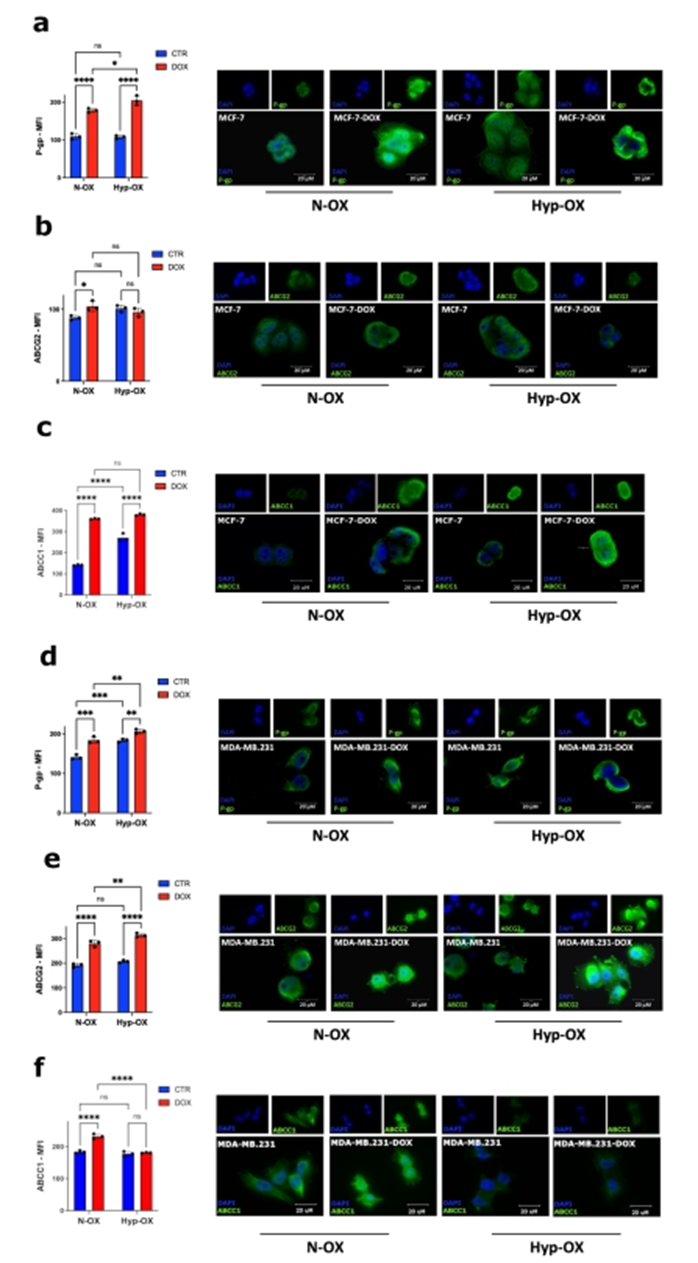
由于ATP結(jié)合盒(ABC)轉(zhuǎn)運(yùn)體參與BC MDR,作者評估了它們在MCP模型中的作用,在誘導(dǎo)缺氧8小時(shí)后,通過熒光顯微鏡和FACS,重點(diǎn)關(guān)注P-gp、ABCG2和ABCC1,隨后用DOX治療。作者選擇DOX,一方面是利用其自身熒光的優(yōu)勢,另一方面是因?yàn)樗?/span>BC腦卒中化療的支柱。在MCF-7中,作者觀察到在兩種氧條件下,DOX處理后P-gp和ABCC1表達(dá)增加,而ABCG2僅在常氧條件下DOX處理后升高(圖5a-c)。在MDA-MB.231在DOX(兩種氧條件下)和缺氧條件下P-gp表達(dá)增加。兩種氧條件下,ABCG2均不受缺氧影響,僅在DOX處理下升高,而ABCC1僅在DOX處理后的常氧條件下升高(圖5d-f)。
隨后,作者將注意力集中在ADM對ABC轉(zhuǎn)運(yùn)蛋白活性的可能影響上。作者初步評估了MCP后DOX對BCCs的細(xì)胞毒性。事實(shí)上,它誘導(dǎo)了Holomonitor監(jiān)測的細(xì)胞活力參數(shù)的增加,在缺氧情況下也是如此。在MDA-MB。作者在常氧條件下獲得了相同的結(jié)果和缺氧(圖6a-d)。之后,作者通過測量DOXMFI來評估DOX細(xì)胞質(zhì)保留。正如預(yù)期的那樣,ABC轉(zhuǎn)運(yùn)蛋白抑制劑VER增加了DOX細(xì)胞質(zhì)積累。然而,ATP代謝在調(diào)節(jié)這些轉(zhuǎn)運(yùn)體的活性方面是至關(guān)重要的。事實(shí)上,在兩種氧氣條件下,ATP合成抑制劑魚藤酮都能顯著降低ABC轉(zhuǎn)運(yùn)體的外排能力,而這種作用被D-Glu顯著逆轉(zhuǎn)(圖6e-h)。這些結(jié)果強(qiáng)調(diào),ABC轉(zhuǎn)運(yùn)蛋白活性嚴(yán)格依賴于ATP的可用性,獨(dú)立于細(xì)胞呼吸。
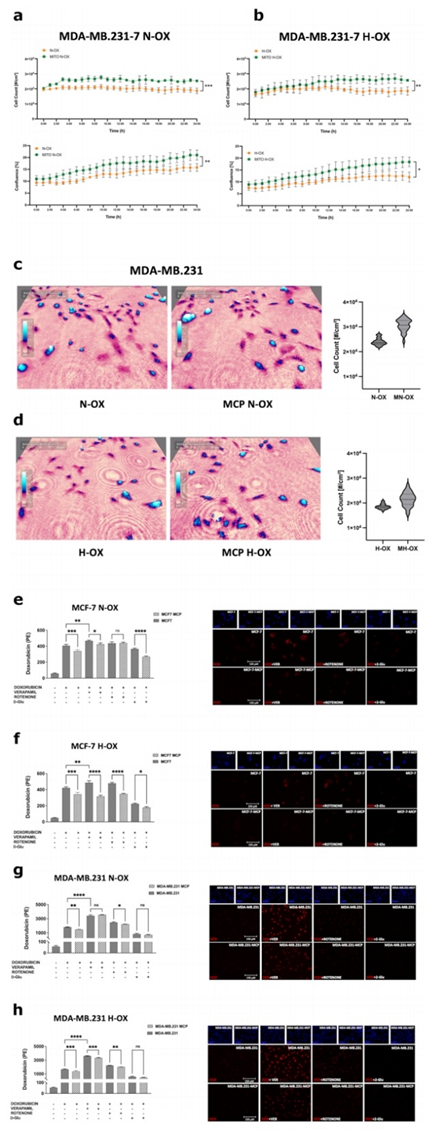
在攜帶ADM的MCF-7中,作者發(fā)現(xiàn)DOX積累減少(DOXMFI < 16%),即使在VER治療后(DOXMFI < 9%),魚藤酮治療后無明顯差異(圖6e)。然而,D-Glu再次增強(qiáng)了ADM介導(dǎo)的效應(yīng)(DOXMFI < 27%)。在缺氧時(shí),MCP更有效。在這種情況下,作者證明ADM增加了藥物外排率(DOXMFI < 18%),即使使用VER抑制ABC轉(zhuǎn)運(yùn)蛋白(DOXMFI < 35%)。有趣的是,雖然魚藤酮介導(dǎo)的ATP合成阻斷會影響細(xì)胞的解毒能力,但ADM顯著地恢復(fù)了這種情況(DOXMFI < 27%);D-Glu治療后效果相同(DOXMFI < 26%;圖6f)。
在MDA-MB。作者發(fā)現(xiàn)ADM驅(qū)動(dòng)DOX耐藥。具體來說,ADM顯著降低了DOX積累(DOXMFI < 18%),而VER組無顯著影響。同樣,魚藤酮介導(dǎo)的DOX積累被MCP有效抵消。在MDA-MB.231 MCP在缺氧時(shí)的作用更為明顯。在這種情況下,DOX細(xì)胞質(zhì)水平顯著降低(DOXMFI < 18%),給藥后DOXMFI < 8%)。此外,魚藤酮處理后,MCP對ABC轉(zhuǎn)運(yùn)蛋白活性的調(diào)節(jié)是明顯的,但與D-Glu無關(guān)(圖6g-h)。考慮到所有這些結(jié)果,作者發(fā)現(xiàn)ADM激活了ABC轉(zhuǎn)運(yùn)蛋白進(jìn)入MCF7和MDA-MB.231,導(dǎo)致細(xì)胞質(zhì)內(nèi)藥物積累的顯著減少和逃避化療誘導(dǎo)的細(xì)胞毒性。
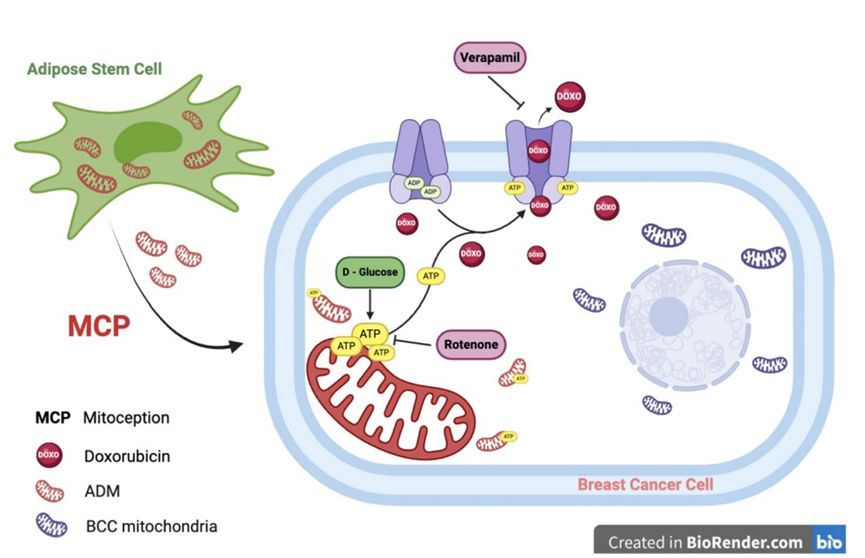
具體來說,作者證明了MCP代謝促進(jìn)BC受體細(xì)胞,導(dǎo)致細(xì)胞內(nèi)ATP增加,ATP是ABC轉(zhuǎn)運(yùn)體的直接分子激活劑。這些外排泵在BCCs MDR中發(fā)揮著關(guān)鍵作用,正如作者的模型所證明的那樣,作者發(fā)現(xiàn)在兩種氧氣條件下,通過選擇性地用VER阻斷ABC受體,細(xì)胞內(nèi)DOX顯著增加。作者的研究結(jié)果表明,攝取ADM后產(chǎn)生的ATP增加是BCCs中ABC受體外排的關(guān)鍵調(diào)節(jié)劑。事實(shí)上,當(dāng)作者用魚藤酮阻斷ATP合成時(shí),作者看到DOX細(xì)胞質(zhì)保留增加,表明ABC轉(zhuǎn)運(yùn)蛋白功能下調(diào)。另一方面,給藥D-Glu逆轉(zhuǎn)了這種抑制,重新激活ABC外排活性(圖7)。
總之,作者首次證明MT促進(jìn)廣泛的BCCs變化,導(dǎo)致更耐藥的表型。作者發(fā)現(xiàn)pdASCs與BCCs相互作用,提供它們自己的線粒體。這種MT與細(xì)胞結(jié)構(gòu)重塑密切相關(guān),這使得物理細(xì)胞-細(xì)胞接觸成為可能。這一機(jī)制驅(qū)動(dòng)了受體癌細(xì)胞的許多功能效應(yīng),這些效應(yīng)受益于這一過程。事實(shí)上,作者發(fā)現(xiàn)這些細(xì)胞改善了它們對細(xì)胞外環(huán)境的適應(yīng)性反應(yīng),增加了線粒體呼吸和相對的OXPHOS,上調(diào)了ABC轉(zhuǎn)運(yùn)蛋白活性,從而獲得了一種更好地逃避抗癌治療的表型。有趣的是,作者還在更準(zhǔn)確和可翻譯的體外模型中證明了MT,這些模型再現(xiàn)了起源組織的一些關(guān)鍵方面。此外,作者首次發(fā)現(xiàn)抑制MT可以有效地恢復(fù)對化療的敏感性,使其成為開發(fā)創(chuàng)新治療策略的新潛在靶點(diǎn)。需要進(jìn)一步的研究來更好地闡明癌細(xì)胞吸引外源線粒體的其他途徑的發(fā)生,但這項(xiàng)研究為乳腺癌的新治療開辟了道路,無論是通過阻斷從ASCs到BCCs的MT機(jī)制,還是通過抑制間充質(zhì)干細(xì)胞與腫瘤細(xì)胞之間的相互作用。
下一代測序(NGS),熒光和共聚焦顯微鏡,免疫印跡,細(xì)胞和細(xì)胞培養(yǎng),脂肪干細(xì)胞分離,線粒體轉(zhuǎn)移共培養(yǎng)模型,阿霉素測定,細(xì)胞活力測定,流式細(xì)胞術(shù),細(xì)胞外通量分析,患者來源類器官的生成
Del Vecchio, V., Rehman, A., Panda, S. K., Torsiello, M., Marigliano, M., Nicoletti, M. M., Ferraro, G. A., De Falco, V., Lappano, R., Lieto, E., Pagliuca, F., Caputo, C., La Noce, M., Papaccio, G., Tirino, V., Robinson, N., Desiderio, V., & Papaccio, F. (2024). Mitochondrial transfer from Adipose stem cells to breast cancer cells drives multi-drug resistance. Journal of experimental & clinical cancer research: CR, 43(1), 166. https://doi.org/10.1186/s13046-024-03087-8






