SOC預后不良新預測因子出現!這一條去泛素化途徑你學會了嗎?
漿液性卵巢癌(serous ovarian cancer, SOC)的預后不良是由于SOC細胞的高侵襲能力和順鉑抗性,而分子機制仍然知之甚少。Snail是EMT的經典生物標志物,它在癌細胞癌變,進展,轉移和化學耐藥性中起著重要作用。本研究分別通過免疫組織化學、體外和體內研究鑒定編碼非肌西北肌球蛋白重鏈IIB的基因MYH10在SOC中的表達和功能。MYH10的機制通過共免疫沉淀、GST pull-down、共聚焦激光測定等得到證實。結果表明,敲低MYH10在體內外均抑制SOC細胞的增殖、遷移、侵襲、轉移和順鉑耐藥性。進一步的研究證實,MYH10蛋白功能結構域與編碼非肌西北肌球蛋白重鏈IIA的基因MYH9結合,募集去泛素特異性蛋白酶45,通過去泛素化snail以抑制其蛋白質降解,最終促進SOC中的腫瘤發生,進展和順鉑耐藥性。在臨床樣品中,與副腫瘤樣品相比,SOC樣品中的MYH10表達顯著升高。MYH10的表達與MYH9的表達呈正相關。MYH10+/MYH9+共表達是預測SOC患者生存的獨立預后因素。這些發現揭示了MYH10-MYH9-Snail軸在SOC致癌、進展和順鉑耐藥性中的關鍵作用,并為SOC干預提供潛在的新治療靶點。本文于2023年5月發表在《Advanced science (Weinheim, Baden-Wurttemberg, Germany)》IF:15.1期刊上。
技術路線

主要實驗結果
1、MYH10在SOC樣品中表達上調并預測預后不良
為探究MYH10在SOC樣品中的臨床意義,本研究進行IHC以檢測MYH10蛋白表達(圖1B,C),結果顯示與腫瘤旁樣品相比,SOC樣品中MYH10的蛋白表達上調(圖1A)。重要的是,Kaplan-Meier分析表明,高MYH10表達與SOC樣品中較短的總生存期(OS)和無復發生存期(RFS)相關(圖1D)。此外,MYH10表達與FIGO分期,腹膜內轉移和腸道轉移等因素都相關(表1)。這些結果表明MYH10在SOC中表達上調,并可預測不良預后。
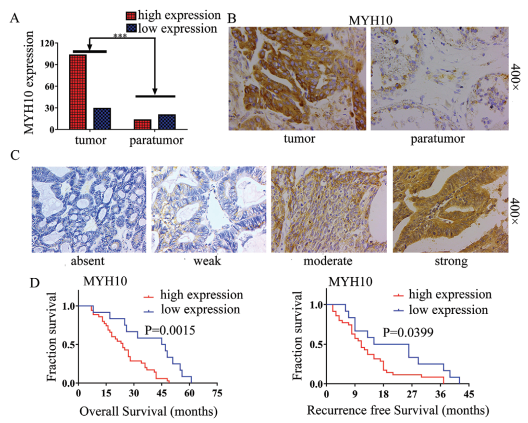
圖1 上調MYH10可預測SOC患者預后不良
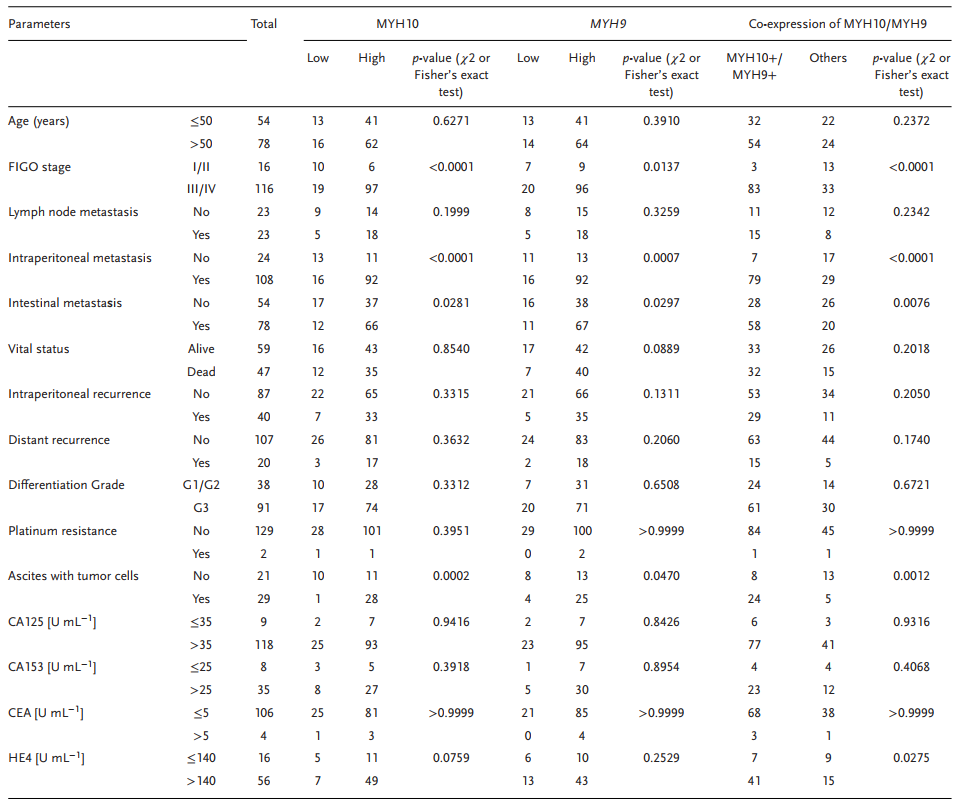
表1 使用χ2或Fisher’s精確檢驗與標準臨床病理變量相關的MYH10,MYH9或MYH10/MYH9表達
2、敲低MYH10在體內外抑制SOC中的腫瘤發生、進展和順鉑耐藥性
為驗證MYH10的致癌功能,本研究使用不同的siRNA有效地敲低SOC細胞中MYH10的表達。使用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑溴化物(MTT),Edu和集落形成測定(圖2A-C)發現敲低MYH10抑制SOC細胞生長和增殖。此外,Transwell,Boyden和細胞劃痕實驗表明敲低MYH10能抑制SOC細胞的遷移和侵襲能力(圖2D,E),體外藥物敏感性試驗顯示MYH10敲低細胞的IC50值在統計學上低于對照(圖2G),并且這種效應在shMYH10裸鼠異種移植物模型體內進一步證實(圖2F)。Kaplan-Meier方法估計的生存時間證實,與未處理的正常對照(NC+NS)相比,單獨的順鉑治療(NC+順鉑)或shMYH10(shMYH10+生理鹽水[NS])有效延長生存期。然而,shMYH10+順鉑組顯著延長生存時間,超過其他三組(圖2F)。NC+NS組的中位生存期為20天,shMYH10+NS組為31.5天,順鉑+NS組為38.5天,shMYH10+順鉑組為47.5天。此外,為了探究MYH10是否影響腫瘤生長和肺轉移,在裸鼠中進行皮下和尾靜脈注射的移植腫瘤實驗,結果顯示敲低MYH10抑制體內腫瘤的增殖(圖2H)和轉移(圖2I),注射shMYH10細胞的小鼠與對照相比表現出較低的腫瘤大小和重量。此外,蛋白印跡分析顯示EMT信號包括N-鈣粘蛋白,波形蛋白,snail和slug被顯著抑制,而E-鈣粘蛋白顯著上調(圖2J)。這些結果表明,MYH10基因的敲低通過EMT信號在體內外抑制SOC的增殖、遷移、侵襲、轉移和順鉑耐藥。這些數據表明MYH10作為一種癌蛋白,在體內外促進SOC癌變、進展和順鉑耐藥。
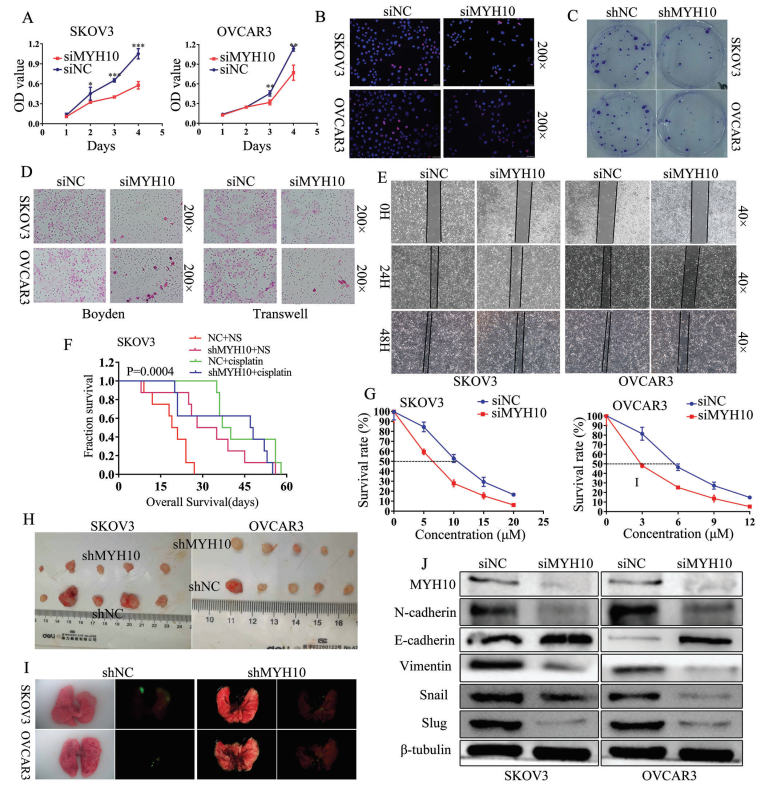
圖2 MYH10基因敲低通過失活EMT信號抑制SOC細胞增殖、遷移、侵襲、轉移和順鉑耐藥
3、MYH10去泛素化snail
為進一步確定MYH10在SOC細胞中的作用機制,該研究使用Biogrid生物信息學網站來預測候選互作蛋白,發現snail是MYH10的候選互作蛋白。此外,作者使用RT-qPCR和WB來檢測MYH10敲低后snail的表達,發現snail的mRNA表達沒有改變(圖3A),而蛋白質表達在MYH10敲低后下調(圖2L)。此外還使用內源性Co-IP測定觀察到MYH10與snail相互作用(圖3B),接下來驗證MYH10是否通過抑制其在SOC細胞中的泛素化來減少snail降解。用特異性抗snail抗體免疫沉淀snail,并用抗泛素抗體分析其泛素化狀態。正如預期的那樣,過表達MYH10顯著降低snail的泛素化水平(圖3C)。此外,共聚焦激光測定證實MYH10和snail共定位于SOC細胞質中(圖3D),并且MYH10敲低可以在不同時間點損害用cicloheximide和MG132處理的SOC細胞中snail的穩定性(圖3E,F)。
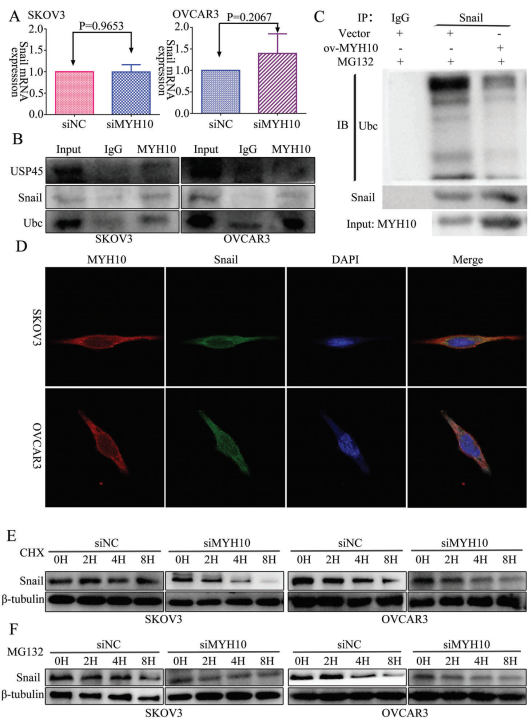
圖3 MYH10去泛素化snail蛋白
4、MYH10與MYH9在SOC細胞中結合
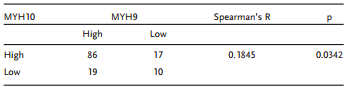
為進一步驗證MYH10在SOC細胞中的詳細機制,作者再次使用Biogrid預測候選互作蛋白,發現MYH9是MYH10的候選互作蛋白。在以前的研究中已得到,MYH9在OC組織中上調,并通過調節Wnt/β-連環蛋白途徑和EMT信號促進SOC增殖,遷移,侵襲和轉移。此外,作者使用外源性和內源性Co-IP測定得到MYH10功能結構域(≈879-1959aa)與MYH9相互作用(圖4C-F),并且共聚焦激光測定證實MYH10和MYH9共定位在SOC細胞細胞質中(圖4G)。此外,GST pull-down分析表明,在SOC細胞系中,MYH10可以直接結合MYH9(圖4D)。此外,為了確定MYH10和MYH9表達之間的關系,該研究在總共132對SOC樣品中進行了IHC(圖4A)。Kaplan-Meier分析清楚地顯示MYH10+/MYH9+患者的OS或RFS比其他表達更短(圖4B)。MYH10+/MYH9+表達與FIGO分期,腹膜內轉移,腸道轉移,腹水腫瘤細胞和血清HE4水平直接相關。此外,MYH10+/MYH9+共表達確實是一個獨立的預后因素,而不是使用多變量分析單獨使用MYH10或MYH9(表2)。值得注意的是,在SOC樣品中檢測到MYH10和MYH9蛋白水平之間正相關(表3)。
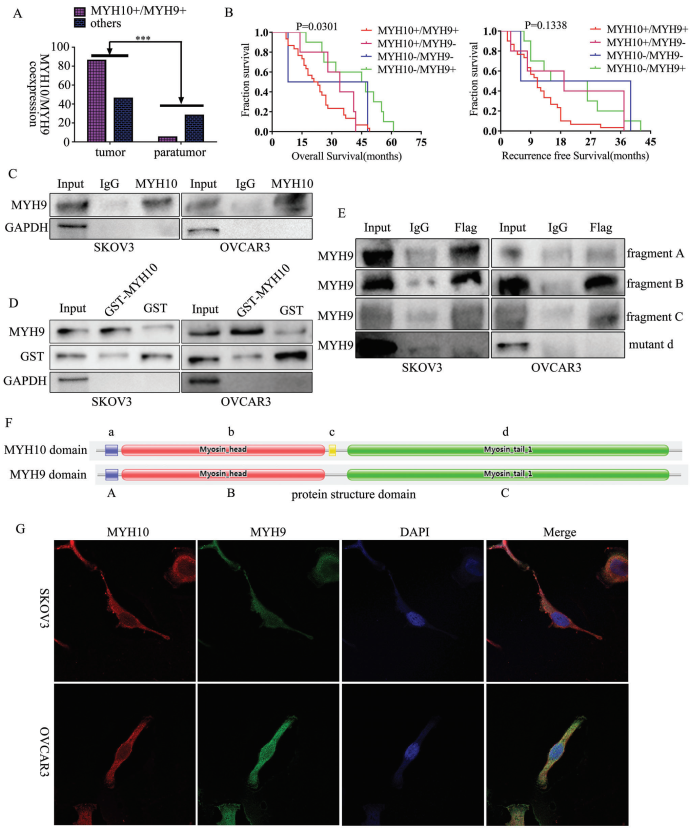
圖4 MYH10在SOC細胞中與MYH9結合
表2 SOC預后因素的單變量和多變量Cox回歸分析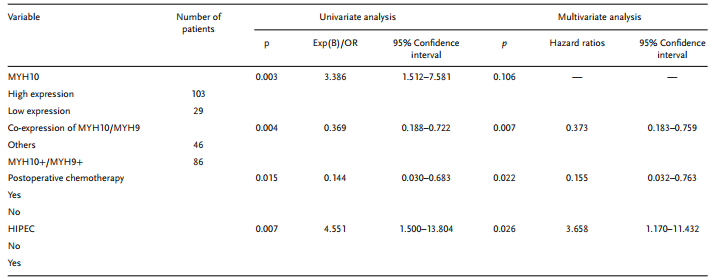
表3 MYH10與MYH9表達的相關性研究
5、MYH9招募USP45去泛素化snail
在作者之前的研究中已知,MYH9通過調節Wnt/β-連環蛋白途徑和EMT信號促進OC的增殖、遷移、侵襲和轉移。為探究MYH9對snail的影響,作者使用RT-qPCR和WB來檢測MYH9敲低后snail的表達,結果顯示snail的mRNA表達沒有改變(圖5A),而在snail的蛋白質表達下調(圖5B)。為進一步驗證MYH9在SOC細胞中的作用機制,作者應用Biogrid生物信息學網站來預測候選互作蛋白,發現USP45和snail是MYH9的候選互作蛋白。此外,內源性Co-IP分析發現MYH9可以分別與USP45,snail和泛素互作(圖5C),并且Co-IP測定表明USP45敲低能改善MYH9對snail去泛素化和穩定性的影響(圖5D)。此外,共聚焦激光測定證實MYH9和USP45以及MYH9和snail都共定位于SOC細胞細胞質中(圖5G,H),MYH9敲低或過表達可能損害用cicloheximide和MG132處理的SOC細胞中snail在不同時間點的穩定性(圖5E,F)。此外,該研究發現USP45敲低也可以損害cicloheximide和MG132處理的SOC細胞中snail在不同時間點的穩定性(圖5I,J)。
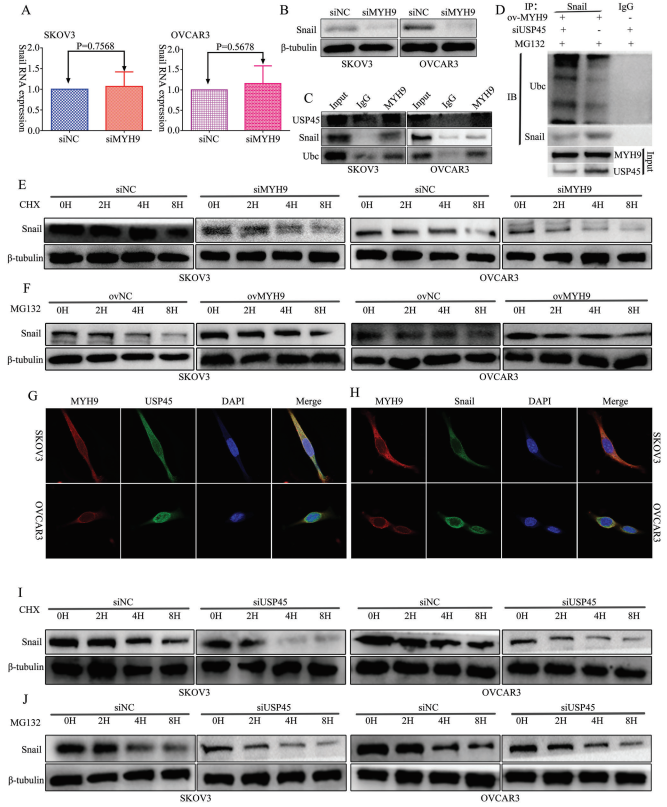
圖5 MYH9招募USP45去泛素化snail
6、MYH10對SOC癌變、進展和順鉑耐藥的促進作用可通過敲低MYH9逆轉
為確定MYH9敲低是否逆轉MYH10對SOC癌發生,進展和順鉑耐藥性的促進,進行MTT和EdU測定以驗證siMYH9對MYH10過表達的SOC細胞增殖的作用(圖6A,C)。另外,進行Transwell和細胞劃痕實驗探究siMYH9對MYH10過表達的SOC細胞遷移和侵襲的逆轉作用(圖6D,E)。此外,檢測IC50值以驗證siMYH9對MYH10過表達的SOC細胞的作用(圖6B),并進行WB以探究潛在的機制。WB顯示MYH9敲低能逆轉MYH10對EMT信號的促進(圖6F)。這些數據表明MYH10對SOC癌發生、進展和順鉑耐藥性的促進作用可以通過敲低MYH9來逆轉。

圖6 敲低MYH9可逆轉MYH10誘導的SOC癌變、進展和順鉑耐藥
7、MYH9對SOC致癌、進展和順鉑耐藥的促進作用可通過敲低snail逆轉
為確定snail敲低是否逆轉MYH9對SOC癌發生,進展和順鉑耐藥性的促進,進行MTT和EdU測定以驗證si-snail對MYH9過表達的SOC細胞增殖的作用(圖7A,C)。另外,進行Transwell和細胞劃痕實驗探究si-snail對MYH9過表達的SOC細胞遷移和侵襲的逆轉作用(圖7D,E)。此外,檢測IC50值以驗證si-snail對MYH9過表達的SOC細胞的作用(圖7B),并進行WB以探究其潛在的機制,WB顯示snail敲低能逆轉MYH9對EMT信號的促進(圖7F)。這些數據表明,MYH9對SOC癌發生、進展和順鉑耐藥性的促進作用可以通過敲低snail來逆轉。
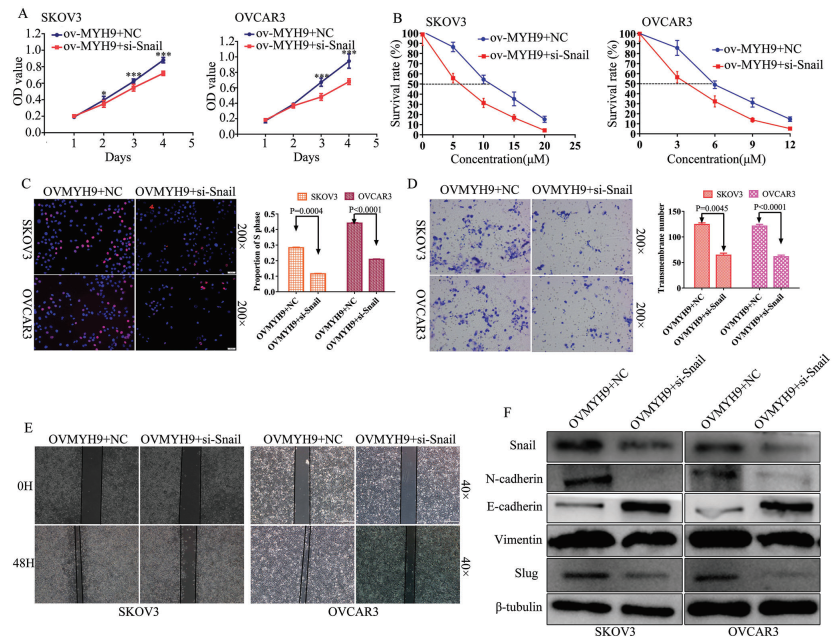
圖7 敲低snail可逆轉MYH9誘導的SOC癌變、進展和順鉑耐藥

圖8 本研究模型圖
綜上所述,本研究表明,MYH10在SOC樣本中上調,并預測SOC患者的預后不良。MYH10作為SOC中的癌基因,促進順鉑耐藥。MYH9是MYH10互作蛋白,通過招募USP45去泛素化snail導致EMT信號通路激活,從而促進SOC癌變、進展和順鉑耐藥(圖8)。該研究為理解與SOC發生、進展和順鉑耐藥相關的分子機制提供新的見解,并為SOC治療提供潛在的生物標志物。
實驗方法
轉染,qRT-PCR,MTT Assay,EdU分析,Transwell實驗,細胞劃痕實驗,裸鼠體內外順鉑治療實驗,WB,Co-IP,GST pull-down,菌落形成實驗,共聚焦激光分析,動物增殖與轉移研究,免疫組織化學(IHC)染色
參考文獻
Liu L, Chen C, Liu P, et al. MYH10 Combines with MYH9 to Recruit USP45 by Deubiquitinating Snail and Promotes Serous Ovarian Cancer Carcinogenesis, Progression, and Cisplatin Resistance. Adv Sci (Weinh). 2023; 10 (14): e2203423. doi:10.1002/advs.202203423






