circSLC4A7-胃癌的新靶點
胃癌干細胞(GCSCs)在胃癌的發生和發展中起著至關重要的作用。 circRNAs參與多種癌癥生物學過程,并作為腫瘤抑制因子或癌基因發揮作用。本研究旨在發現circRNAs在GCSCs中的表達譜和功能作用。對circRNA的全基因組測序顯示,一種新的circRNA,circSLC4A7是GCSCs中表達上調最多的circRNA之一。circSLC4A7定位于細胞核,其水平在GC細胞和組織中升高。此外,circSLC4A7增加了CSC樣特性,并驅動細胞增殖、遷移和侵襲。機制上,HSP90與circSLC4A7相互作用,通過激活GC中Notch1信號通路介導circSLC4A7的致癌功能。本研究強調了circSLC4A7通過與HSP90結合從而激活Notch1信號通路介導的一種新的致癌功能。本文于2023年7月發表于Cell Death and Disease(IF=9.0)上。
技術路線

結果
1)circRNA在CSCs和MSCs中的表達譜
我們的研究首先驗證了CSC標記物在球體形成實驗后獲得的細胞中的過表達,并在mRNA和蛋白質水平上與單層細胞(MCs)的標記物豐度進行了比較(圖1A, B)。接著,我們從3對GC SCs和MCs中提取總RNA,并進行第二代測序以鑒定差異表達的circRNA(圖1C)。基因聚類分析顯示,203個circRNA表達上調,213個circRNA表達下調(圖D)。為了驗證基因聚類分析的結果,我們進一步通過qRT-PCR檢測了4株GC細胞系(MGC803、AGS、BGC823和SGC7901)中6個上調最多的circRNA和4個下調最多的circRNA的表達。與MCs相比,CircRNA_0064618 (circ0064618)在4種SCs中的過表達水平最高(圖1E)。CD44陽性GC細胞中circ0064618的表達水平明顯高于CD44陰性細胞(圖1F)。而且,在GES1細胞中circ0064168的表達水平遠低于GC細胞系(圖1G)。GC組織中circSLC4A7的表達水平明顯高于腫瘤鄰近組織(圖1H)。這些結果提示circ0064618可能在GCSCs中發揮關鍵作用。此外,AGS和BGC823細胞中circ0064618的表達水平高于MGC803和SGC7901細胞。因此,circ0064618在MGC803和SGC7901細胞中異位過表達,而在AGS和BGC823細胞中沉默,以研究其生物學功能。
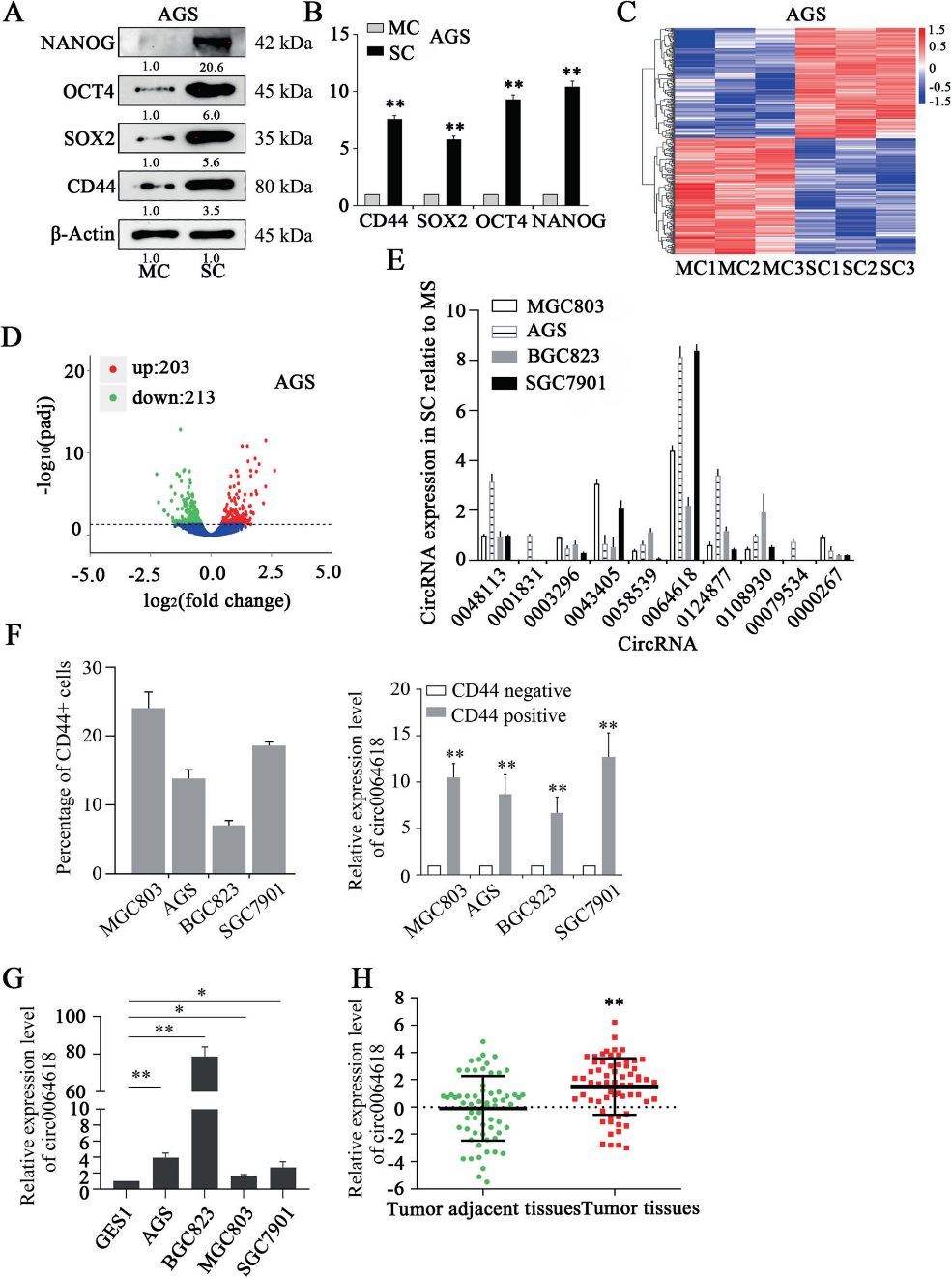
2)circSLC4A7在胃癌細胞中的特異性特征及預后價值
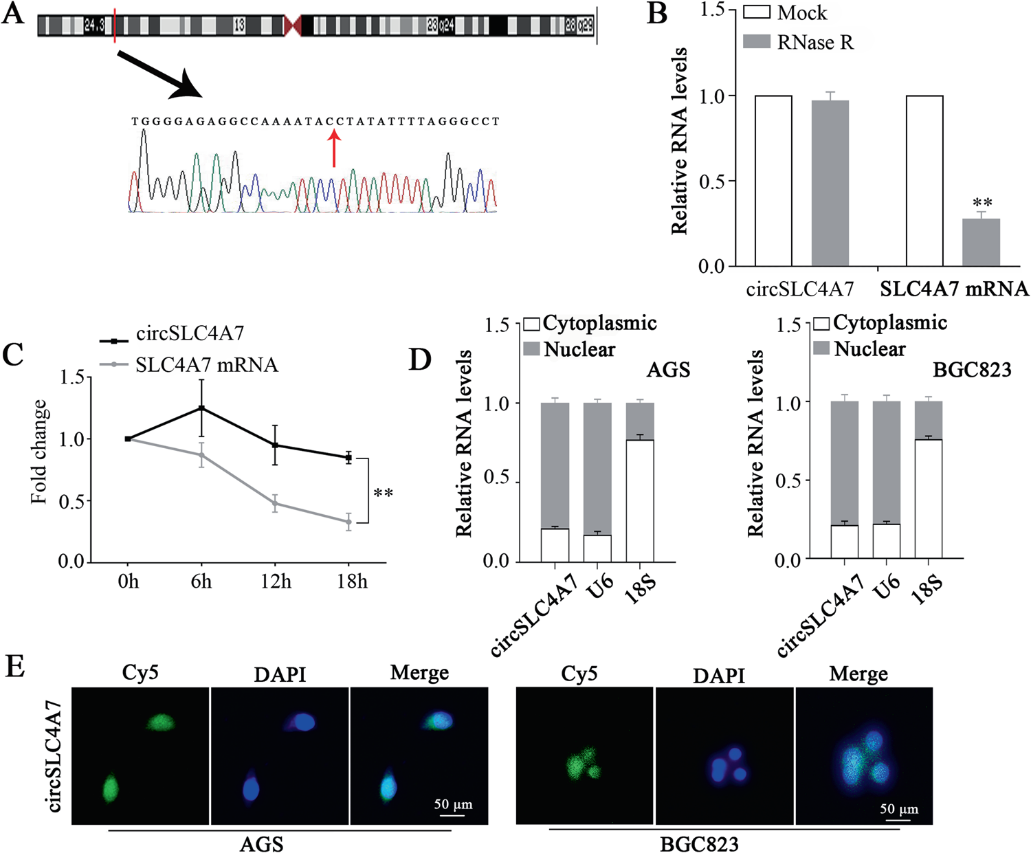
Circ0064618由位于3號染色體的SLC4A7基因編碼(圖2A),因此,Circ0064618被稱為circSLC4A7。對RNase R外切酶的抗性證實了RNA是環狀的(圖2B)。值得注意的是,在Actinomycin D處理后,circSLC4A7顯示出比SLC4A7 mRNA更長的半衰期(圖2C)。通過mRNA分離(圖2D)和FISH (圖2E)的進一步檢查表明,circSLC4A7優先定位于細胞核。
3)circSLC4A7的表達與胃癌的干性呈正相關
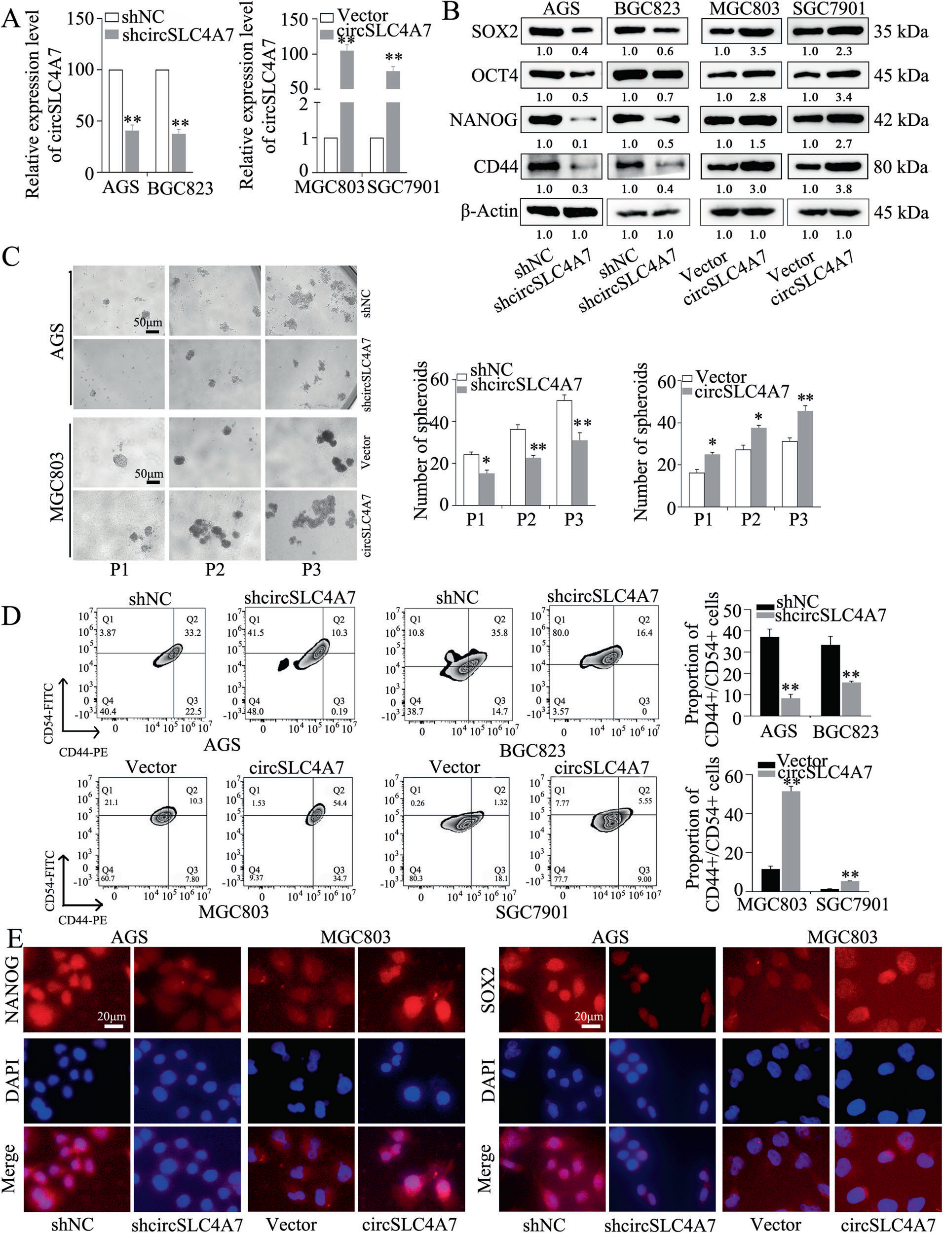
我們研究了circSLC4A7在GC中的精確功能。用circSLC4A7 shRNA穩定轉染后,在AGS和BGC823細胞中circSLC4A7的表達量大大降低,用過表達載體轉染后,在MGC803和SGC7901細胞中circSLC4A7的表達量顯著上調(圖3A)。我們的研究結果顯示,在GCSCs中circSLC4A7的表達顯著升高。因此,我們研究了circSLC4A7是否對干細胞潛能有影響。Western blotting檢測表明,在AGS和BGC823細胞中沉默circSLC4A7可明顯抑制CSC標志物SOX2、OCT4、NANOG和CD44的表達。此外,circSLC4A7過表達增加了CSC標志物的表達(圖3B)。此外,在AGS和BGC823細胞中,敲低circSLC4A7顯著減少了球體形成實驗中腫瘤球體的數量,異位過表達circSLC4A7增加了腫瘤球體形成的數量(圖3C)。流式細胞術檢測證實,circSLC4A7沉默的細胞中CD44+/CD54+細胞的比例下降。circSLC4A7過表達細胞中CD44+/CD54+細胞比例增加(圖3D)。IF實驗進一步證實NANOG和SOX2在AGS-shcircSLC4A7細胞和BGC823-shcircSLC4A7細胞中表達下調(圖3E),而NANOG和SOX2在MGC803-circSLC4A7細胞和SGC7901-circSLC4A7細胞中表達上調(圖3E)。這些結果表明,circSLC4A7增加了GC細胞的CSC容量。
4)circSLC4A7加速GC細胞的遷移、侵襲和增殖
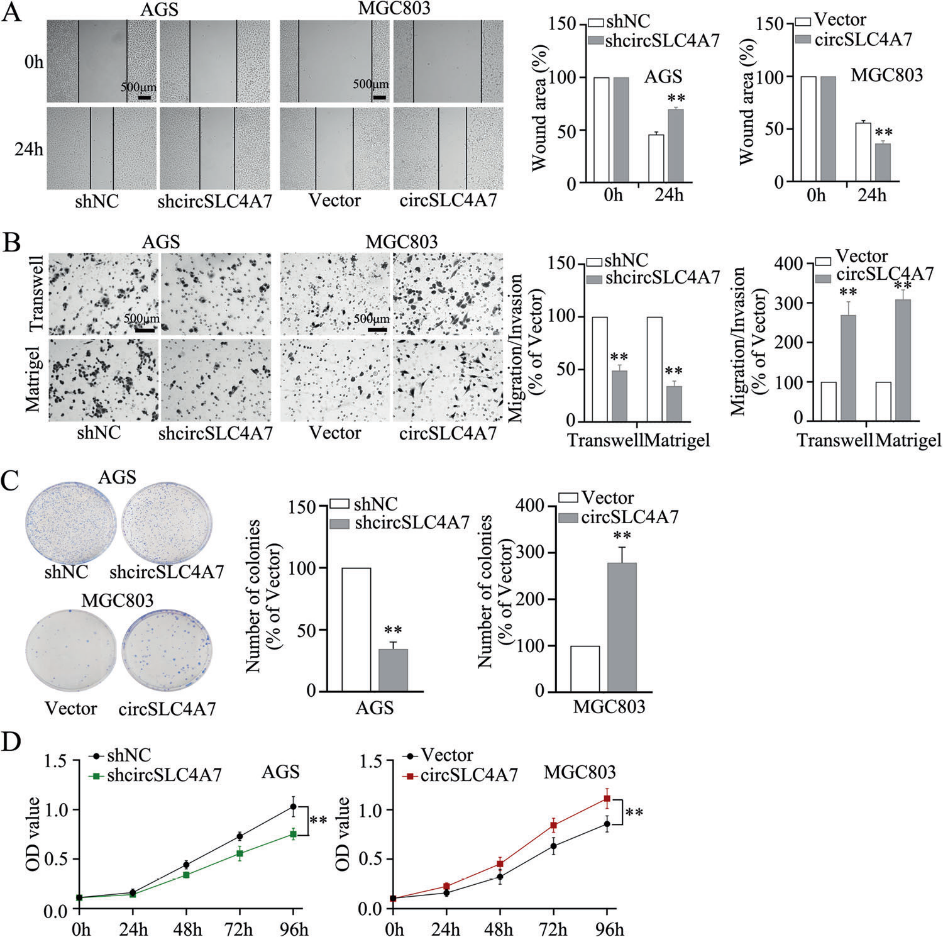
為了檢測circSLC4A7在CSC相關行為中的作用,我們研究了GC細胞的轉移和增殖能力。一項傷口愈合試驗顯示敲低circSLC4A7明顯阻礙了GC細胞的遷移,異位表達circSLC4A7促進了GC細胞的遷移(圖4A)。Transwell實驗進一步證實了這些結果(圖4B)。此外,我們在集落形成和CCK-8實驗中證明了抑制circSLC4A7顯著延緩了細胞增殖,過表達circSLC4A7加速了細胞增殖(圖4C、D)。綜上所述,這些發現表明circSLC4A7促進了GC的遷移、侵襲和增殖。
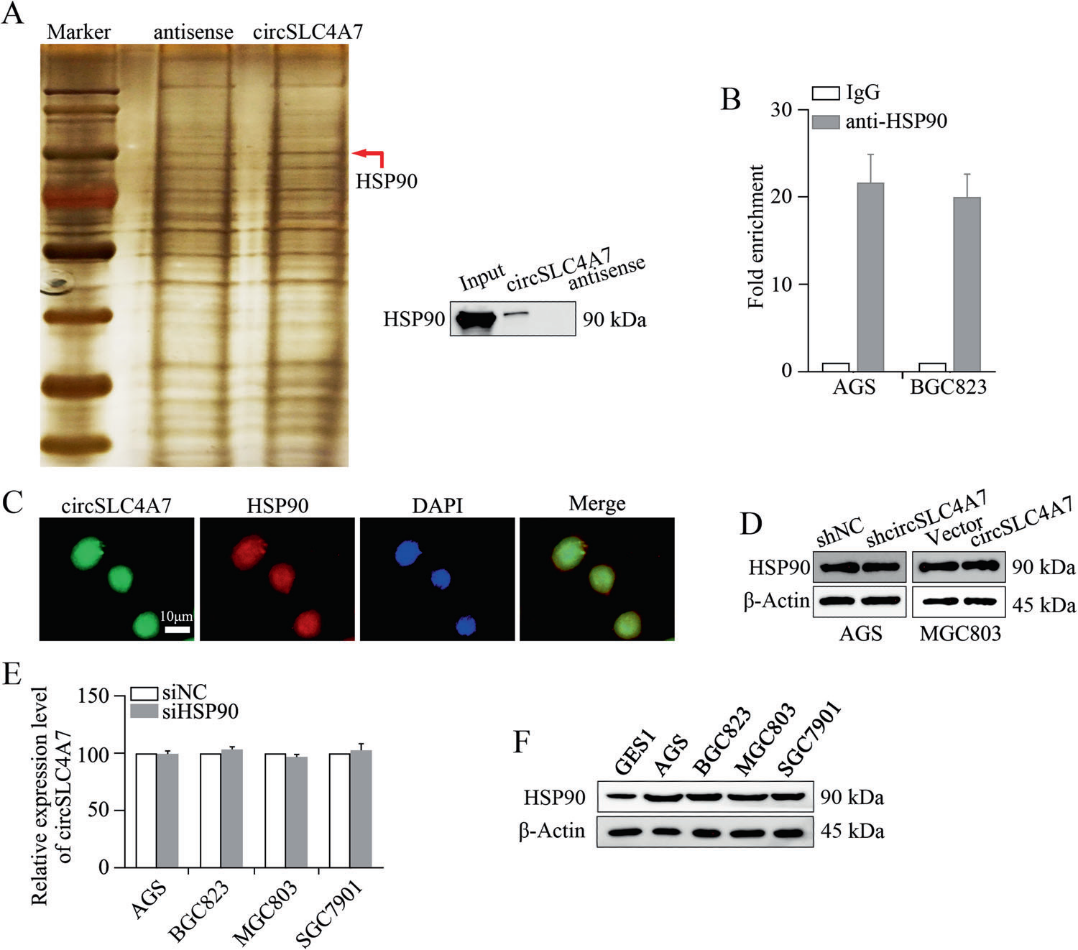
5)circSLC4A7與HSP90相互作用
隨后,我們研究了circSCL4A7在GC進程中發揮作用的機制。為了確定circSLC4A7的蛋白伴侶,我們進行了生物素標記的RNA下拉實驗,然后對癌細胞中的RNA相關蛋白復合物進行了蛋白質組學分析。質譜分析顯示,BGC823細胞中有169種蛋白可能與circSLC4A7相互作用。HSP90的表達發生了很大的變化(圖5A)。Western blotting進一步證實了HSP90的差異表達(圖5A)。此外,RIP實驗表明在AGS細胞和BGC823細胞中,circSLC4A7在與抗HSP90抗體共沉淀的RNA中內源性富集,證明了circSLC4A7與HSP90之間的相互作用(圖5B)。此外,通過雙RNA-FISH和免疫熒光法鑒定了BGC823細胞中circSLC4A7和HSP90的重疊定位(圖5C)。調節circSLC4A7在AGS和MGC803細胞中的表達后,HSP90的表達不受影響(圖5D)。在siHSP90或siNC轉染的細胞中,circSLC4A7的相對表達水平也相當(圖5E)。在GES1和GC細胞(AGS、BGC823、MGC803和SGC7901細胞)中,HSP90的相對表達與circSLC4A7的相對表達一致(圖5F)。結果表明,在GC細胞中,circSLC4A7與HSP90相互作用。
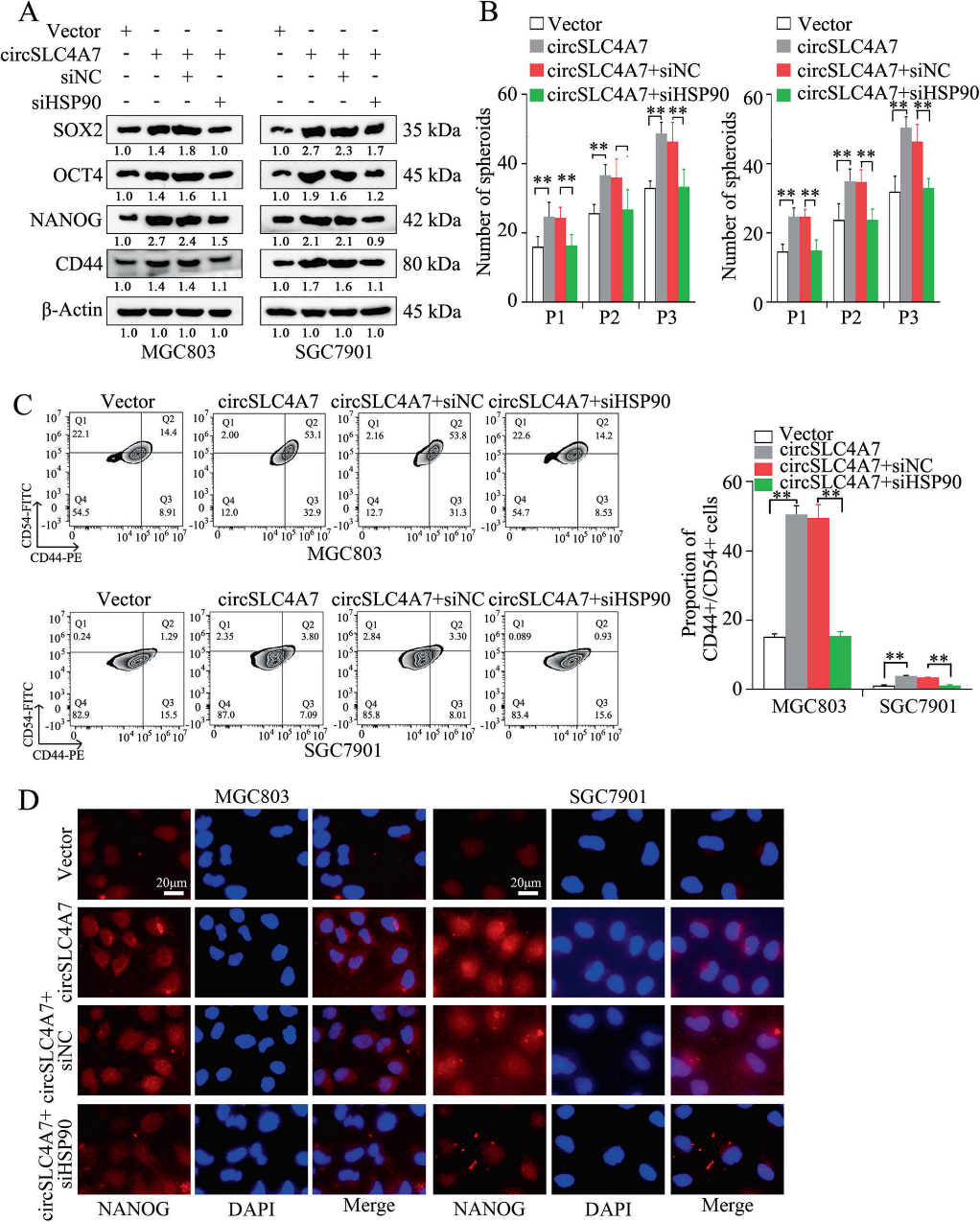
6)circSLC4A7通過與GC中的HSP90相互作用發揮作用
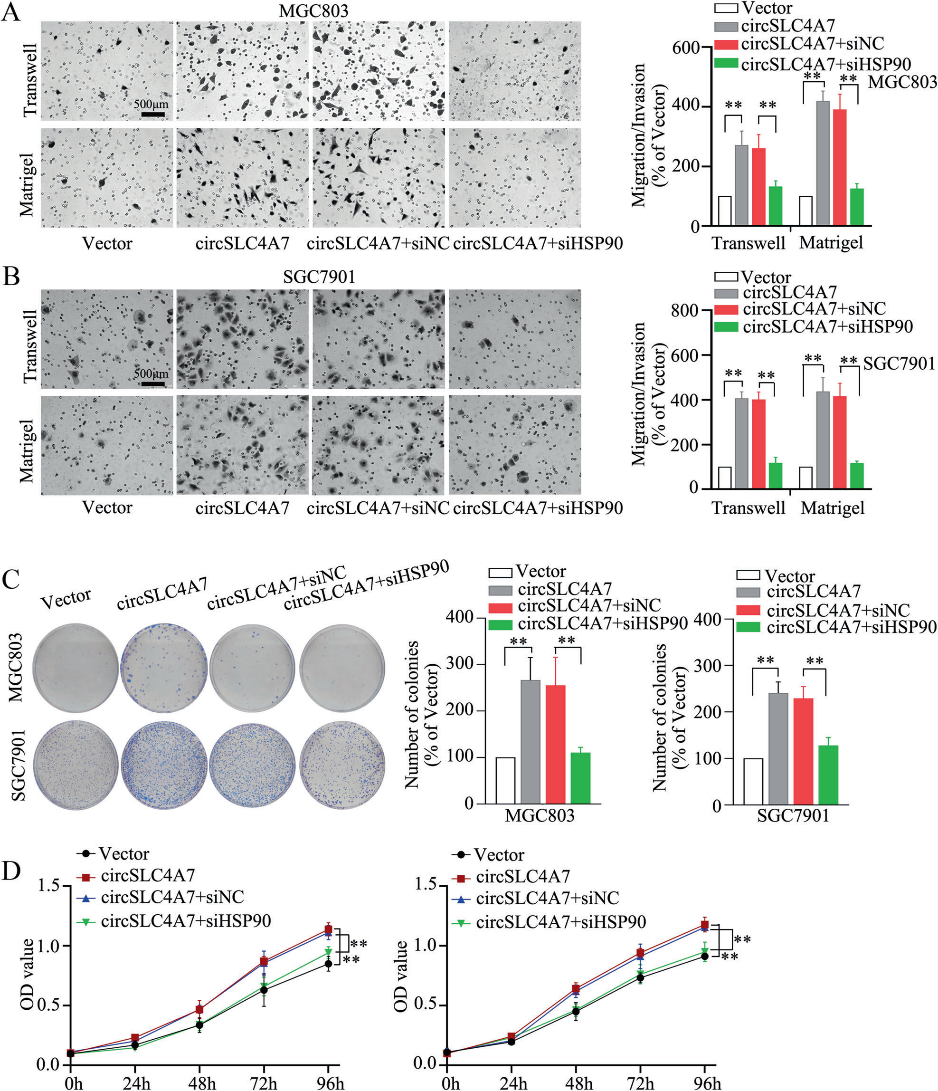
通過抑制過表達circSLC4A7的細胞(MGC803-circSLC4A7和SGC7901-circSLC4A7細胞)中HSP90的表達,研究HSP90表達對GC細胞中circSLC4A7功能作用的影響。結果顯示,通過Western blotting(圖6A)檢測,HSP90沉默抑制了CSC標記物(SOX2, OCT4, NANOG和CD44)的上調(圖6A)。球體形成實驗中形成的球體數量的增加也減弱了(圖6B)。流式細胞術檢測顯示,siHSP90逆轉了circSLC4A7過表達引起的CD44+/ CD54+細胞比例的增加(圖6C)。IF檢測顯示,抑制HSP90顯著降低了由異位circSLC4A7表達引起的CSC標志物(NANOG和SOX2)的表達增加(圖6D)。此外,通過沉默HSP90也可以抑制過表達circSLC4A7的GC細胞的加速遷移(圖7A、B,上圖)、侵襲(圖7A、B,下圖)和增殖(圖7C、D)。總之,這一證據表明circSLC4A7在GC細胞中通過與HSP90相互作用發揮其功能。
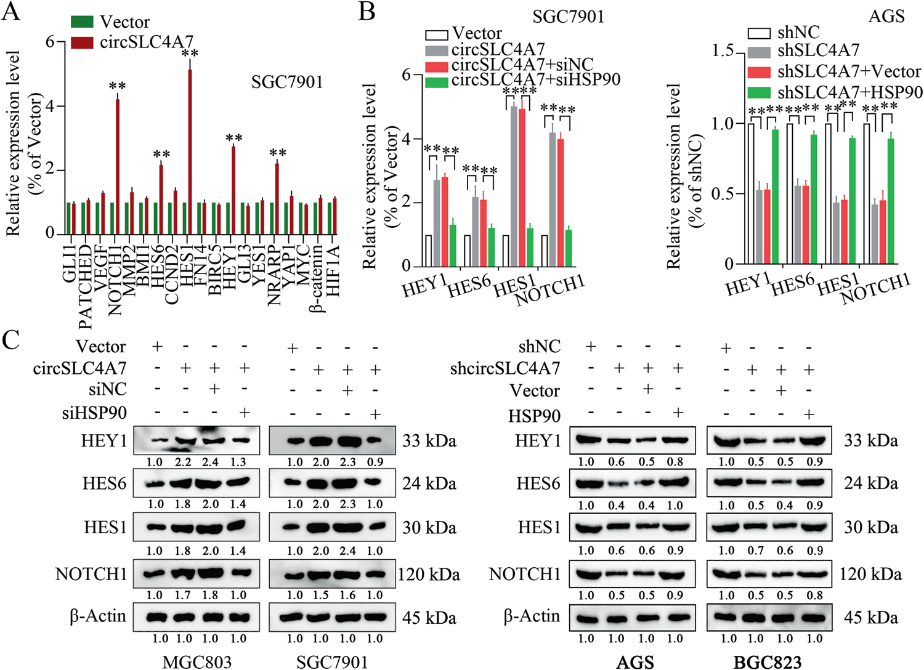
7)circSLC4A7與HSP90結合,通過NOTCH信號通路調節GC中的細胞干性
包括NOTCH信號、Wnt信號、NF-κB信號和Sonic Hedgehog信號在內的幾個關鍵信號通路在調節CSC特性中發揮重要作用。為了確定這些信號通路是否介導circSLC4A7/HSP90復合物在GC中的功能,采用qRT-PCR法檢測其靶基因的表達水平。在qRT-PCR檢測中,Notch信號通路中基因(NOTCH1、HES6、HEY1、HES1、NARP)的表達顯著增加(圖8A)。進一步的測量發現,HSP90沉默逆轉了Notch信號通路中某些基因(NOTCH1、HES6、HEY1和HES1)的上調表達,而HSP90過表達逆轉了Notch信號通路中某些基因(NOTCH1、HES6、HEY1和HES1)在mRNA和蛋白水平上的抑制(圖8B、C)。總之,Notch信號調節circSLC4A7/HSP90復合物在GC中的功能作用。
結論
我們的研究發現circSLC4A7在不影響HSP90表達水平的情況下與HSP90相互作用,進而激活NOTCH1信號通路,調控GC的干性和進展。這些結果表明circSLC4A7是一種新的有希望的GC治療靶點。
實驗方法
成球試驗,RNA pull-down,質譜,RIP,qRT-PCR,Western blot,免疫熒光,CCK-8,集落形成試驗,創傷愈合實驗,Transwell,FISH。
參考文獻
Hui Y, Wenguang Y, Wei S, Haoran W, Shanglei N, Ju L. circSLC4A7 accelerates stemness and progression of gastric cancer by interacting with HSP90 to activate NOTCH1 signaling pathway. Cell Death Dis. 2023 Jul 20;14(7):452. doi: 10.1038/s41419-023-05976-w.






