阻斷長鏈非編碼RNA HOTAIR信號軸可改善化療誘導的膀胱癌惡病質
癌癥惡病質被定義為與癌癥進展相關的復雜代謝紊亂,其特征是體重減輕和骨骼肌萎縮伴或不伴脂肪量減少。值得注意的是,大約三分之一的癌癥相關死亡是由惡病質而不是腫瘤負擔造成的。惡病質對患者的生活質量和身體功能產生負面影響,并與預后和生存率低有關。雖然在了解惡病質的病理生理學方面取得了很大進展,但目前尚無特定的治療方法或干預措施。該研究發表于《Journal of Biomedical Science》,IF: 12.771。
技術路線:
主要研究結果:
1. ProT和HOTAIR在膀胱腫瘤中的表達升高,并顯示出正相關
為了研究HOTAIR及其潛在的上游EGFR-ProT軸對順鉑誘導的膀胱癌惡病質的貢獻,我們首先詢問了HOTAIR,ProT和EGFR是否在臨床膀胱腫瘤組織中過表達。我們通過RT-qPCR檢查了它們在六對膀胱腫瘤組織和相應相鄰正常組織中的表達水平。ProT(圖1a)和HOTAIR(圖1b)在腫瘤組織中的表達明顯高于正常組織對應物。然而,與正常組織相比,膀胱腫瘤中EGFR的表達沒有顯著變化(圖1c)。我們進一步證實了它們在19例膀胱癌患者的腫瘤組織中的關聯。圖1d表明ProT表達與HOTAIR表達呈高度正相關(r = 0.8939,p < 0.0001)。此外,我們分析了TCGA膀胱癌隊列(n=408)的臨床數。我們使用腫瘤免疫估計資源(TIMER,https://cistrome.shinyapps.io/timer)網絡服務器的相關模塊檢查了膀胱腫瘤樣本中ProT(即PTMA基因)、HOTAIR和EGFR轉錄本之間的相互相關性。圖1e表明ProT和HOTAIR的表達水平呈正相關(r = 0.108,p = 0.029)。我們還檢查了ProT和HOTAIR在不同尿路上皮癌細胞系中的表達水平,包括6種膀胱癌、1種前列腺癌(PC3)、1種腎癌(BFTC909)和1種正常尿路上皮(SV-HUC-1)細胞系。我們的結果表明,細胞系在ProT(圖1f)和HOTAIR(圖1g)的表達水平方面呈異質性。在檢查的膀胱癌細胞系中,TCCSUP細胞相對表達最高水平,而J82和HT1197細胞表達最低水平,ProT和HOTAIR。此外,正常的尿路上皮SV-HUC-1細胞表達相對低水平的ProT,特別是HOTAIR。與從臨床腫瘤樣本中獲得的數據一致,ProT和HOTAIR在尿路上皮癌細胞系中的表達水平也呈正相關(r = 0.7661,p = 0.0266)(圖1h)。總之,這些結果表明,ProT和HOTAIR的表達在臨床膀胱腫瘤樣本和癌細胞系中上調并呈正相關。
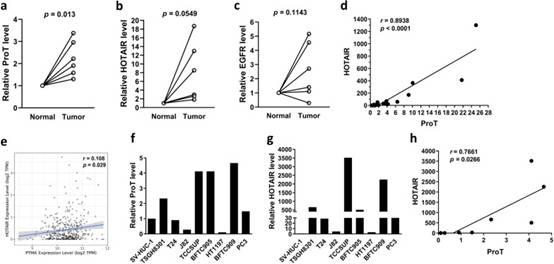
圖1 ProT和HOTAIR在膀胱腫瘤中的表達升高,并顯示出正相關
2. 順鉑治療增加EGFR和NF-κB活化,以及J82細胞中的ProT和HOTAIR表達,并且這些作用被EGFR抑制劑或ProT敲低所消除
鑒于EGFR在膀胱腫瘤中沒有顯著過度表達(圖1c)并且順鉑可以在過表達受體的各種細胞類型中誘導EGFR活化,我們考慮了順鉑誘導EGFR活化的可能性,導致所提出的ProT-NF-κB-HOTAIR信號軸上調,從而導致惡病質相關的促炎細胞因子產生增加。我們用順鉑處理內源性表達相對低水平的ProT和HOTAIR的J82細胞,并在磷酸化方面檢測EGFR活化。NF-κB的活化伴隨著其亞基p65(在Ser 536處)的磷酸化,活化的NF-κB反過來又易位到細胞核中以激活多種促炎基因表達。因此,我們檢查了順鉑處理的J82細胞中ProT和HOTAIR的表達以及NF-κB磷酸化。免疫印跡分析顯示,順鉑處理以劑量依賴性方式增加了磷酸化-EGFR(Tyr1068)、ProT和磷酸化-NF-κB p65(Ser536)的表達(圖2a)。為了確認EGFR的激活作用于ProT-NF-κB-HOTAIR信號軸的上游,使用兩種EGFR激酶抑制劑吉非替尼和厄洛替尼在存在或不存在順鉑的情況下治療J82細胞。我們的結果表明,用吉非替尼或厄洛替尼治療逆轉了順鉑誘導的ProT和磷酸化-NF-κB p65蛋白的上調(圖2b),以及HOTAIR的表達(圖2c)。此外,我們使用慢病毒介導的ProT特異性shRNA遞送(shProT-17和-19)以及J82細胞中的對照shRNA(shLuc)來進一步鑒定ProT作為NF-κB-HOTAIR信號軸的上游調節因子。免疫印跡分析顯示,順鉑誘導的NF-κB磷酸化在ProT敲低J82細胞中被消除(圖2d)。值得注意的是,順鉑誘導的HOTAIR上調在ProT敲低細胞中也被廢除(圖2e)。綜上所述,這些結果表明順鉑可以上調ProT和HOTAIR的表達,并且EGFR和NF-κB的激活參與膀胱癌細胞的這一途徑。此外,順鉑處理通過EGFR-ProT軸上調HOTAIR。
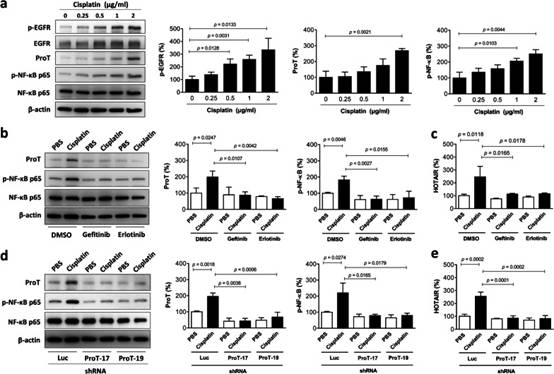
圖2 順鉑治療通過膀胱癌細胞中的EGFR-ProT軸上調HOTAIR
3. ProT的過表達增加,而ProT的敲低降低,膀胱癌細胞中的HOTAIR表達和HOTAIR上調通過NF-κB抑制劑治療而降低
已經證明ProT敲低J82細胞沒有誘導NF-κB磷酸化(圖2d)和HOTAIR上調(圖2e)在順鉑處理后,我們進一步在J82細胞(J82/ProT)中過表達ProT,以檢查其對NF-κB和HOTAIR表達的影響。正如預期的那樣,J82/ProT細胞表達更高水平的ProT mRNA(圖3a)和蛋白質(圖3b),而用GFP和親本(模擬)細胞轉導的細胞中的ProT表達處于相似水平。根據ProT敲低J82細胞的結果(圖2d),在J82細胞中,ProT的過表達增加了NF-κB磷酸化(圖3b)和HOTAIR表達(圖3c)。鑒于ProT可以誘導NF-κB活化,并且NF-κB可以在順鉑誘導的DNA損傷過程中上調HOTAIR表達,我們進一步使用NF-κB抑制劑來研究ProT對HOTAIR表達的影響是否需要NF-κB信號傳導。如圖3c所示,JSH-23抑制NF-κB p65的核易位,從而消除NF-κB信號傳導和TPCA-1,一種抑制NF-κB信號通路活化的激酶IKKβ抑制劑,可以逆轉ProT介導的J82細胞中HOTAIR表達的上調。值得注意的是,用這兩種NF-κB抑制劑治療不影響ProT表達,表明ProT作用于NF-κB信號通路的上游(圖3d)。為了進一步驗證ProT通過NF-κB信號上調HOTAIR表達,我們通過慢病毒介導的ProT特異性shRNA遞送沉默了ProT高表達TCCSUP膀胱癌細胞中的ProT表達,這被RT-qPCR證實(圖3e)和免疫印跡(圖3f)。值得注意的是,敲低ProT表達降低了NF-κB p65磷酸化(圖3f)和HOTAIR表達(圖3g)在 TCCSUP 細胞中。此外,用NF-κB抑制劑處理也降低了TCCSUP細胞中的HOTAIR表達(圖3h),這與ProT敲低的效果相似(圖3g)。總的來說,使用ProT過表達和敲低方法,我們表明抑制NF-κB活化消除了ProT誘導的HOTAIR表達,表明ProT通過激活NF-κB信號通路上調HOTAIR表達。因此,根據從圖2和3獲得的數據,我們得出結論,順鉑誘導的HOTAIR上調是通過EGFR-ProT-NF-κB-HOTAIR信號軸介導的。
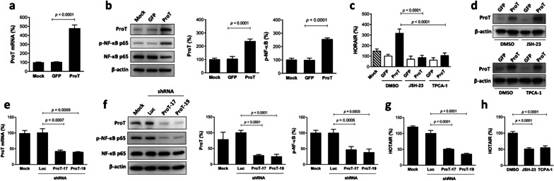
圖3 ProT通過膀胱癌細胞中的NF-κB激活上調HOTAIR
4. HOTAIR的過表達增強J82細胞中的細胞增殖和促炎細胞因子表達
由于HOTAIR可能在炎癥和免疫反應中發揮作用,我們進一步研究了HOTAIR在表達導致癌癥惡病質的促炎細胞因子中的作用。我們生成了HOTAIR過表達J82(J82/HOTAIR-2和-5)細胞及其載體對照(J82/GFP)細胞,并比較了它們的增殖速率和細胞因子表達水平。圖4a證實HOTAIR在J82/HOTAIR細胞中的表達水平遠高于J82/GFP細胞。J82/HOTAIR細胞的增殖速度明顯快于J82/GFP細胞或親本細胞(圖4b)。此外,J82/HOTAIR細胞顯著表達更高水平的IL-6(圖4c)、TNF-α(圖4d)和IL-1β(圖4e)比J82/GFP細胞。鑒于順鉑上調HOTAIR表達和HOTAIR增強J82細胞中的促炎細胞因子表達,我們接下來確定順鉑治療是否上調下游促炎細胞因子,以及EGFR抑制劑是否可以逆轉這種上調。用吉非替尼或厄洛替尼治療消除了順鉑誘導的IL-6上調(圖4f)、TNF-α(圖4g)和IL-1β(圖4h)在J82細胞中的表達。由于ProT充當NF-κB/HOTAIR軸的上游調節器(圖3),我們驗證了J82/ProT細胞表達更高水平的IL-6(圖4i)、TNF-α(圖4j)和IL-1β(圖4k)與載體對照J82/GFP細胞相比。綜上所述,這些結果表明,在人膀胱癌細胞中強制表達HOTAIR或ProT可增強IL-6,TNF-α和IL-1β的表達。此外,順鉑治療后人膀胱癌細胞中促炎細胞因子的表達進一步升高,EGFR抑制劑可消除其作用。
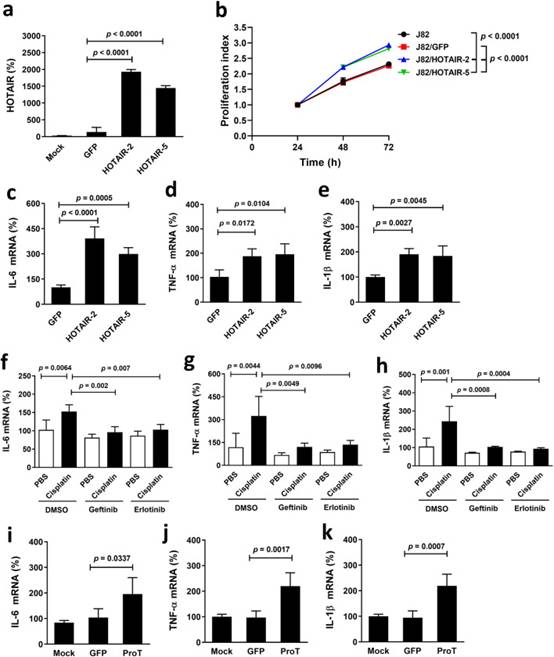
圖4 HOTAIR過表達、順鉑治療和ProT過表達上調人J82膀胱癌細胞中的促炎細胞因子表達
5. 敲低Hotair可降低MBT-2細胞中的細胞增殖和促炎細胞因子表達
在證明了人HOTAIR對人膀胱癌細胞中惡病質相關促炎細胞因子表達的影響后,我們試圖確認小鼠Hotair在小鼠膀胱癌細胞中是否具有與人HOTAIR相似的效果。由于質粒構建體對MBT-2細胞進行瞬時轉染沒有達到較高的轉染效率,因此我們使用慢病毒轉導介導HotairCRISPRi基因沉默。選擇轉導的細胞并在嘌呤霉素處理下擴增,以獲得MBT-2/CSi-HOTAIR和載體對照MBT-2/CSi-GFP細胞。慢病毒轉導和嘌呤霉素選擇后,載體對照和親本細胞之間的一些生物學特性可能不同。因此,將我們的敲低細胞與它們的載體對照細胞而不是親本細胞進行比較。我們測試了CRISPRi介導的Hotair表達敲低是否可以降低小鼠MBT-2膀胱癌細胞中下游促炎細胞因子的表達,這些細胞因子表達這種lncRNA水平升高。圖5a顯示了MBT-2/CSi-Hotair-F4和-F6電池與MBT-2/CSi-GFP電池相比的HOTAIR敲低確認。HOTAIR敲低細胞中的細胞增殖速度慢于GFP敲低細胞或親本細胞(圖5b)。此外,HOTAIR敲低MBT-2細胞表達較低水平的IL-6(圖5c)、TNF-α(圖5d)和IL-1β(圖5e)與GFP敲低細胞相比,盡管IL-1β的差異并不顯著(圖5c,d,e)。值得注意的是,順鉑治療顯著促進了這些細胞因子在GFP敲低細胞中的表達,而不是HOTAIR敲低細胞(圖5c,d,e),表明Hotair的敲低消除了順鉑誘導的小鼠膀胱癌細胞中IL-6,TNF-α和IL-1β的上調。總的來說,這些結果表明,敲低Hotair可降低細胞增殖和促炎細胞因子表達,并減少順鉑誘導的MBT-2細胞中促炎細胞因子的上調。此外,我們的研究結果表明,小鼠Hotair在誘導惡病質相關促炎細胞因子表達方面具有與人類HOTAIR相似的生物學效應。
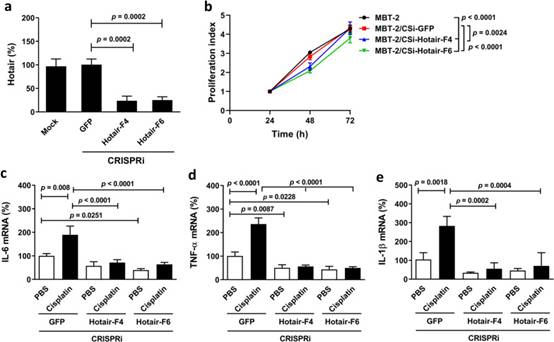
圖5 敲低Hotair可減少小鼠MBT-2膀胱癌細胞中的細胞增殖并下調促炎細胞因子表達
6. HOTAIR與順鉑誘導的膀胱癌骨骼肌萎縮呈正相關
鑒于癌癥惡病質最常見的體外肌肉模型是用從培養的癌細胞中收集的CM治療小鼠C2C12肌管,并且IL-6和TNF-α與癌癥惡病質有關,我們接下來研究了HOTAIR表達與骨骼肌萎縮的相關性。在存在或不存在順鉑的情況下,用J82/HOTAIR,J82/GFP或親本J82細胞的CM處理C2C12肌管,并通過測量肌管直徑評估肌肉萎縮。重組小鼠TNF-α作為誘導C2C12肌管萎縮的陽性對照。鑒于惡病質患者血漿中所含的促炎細胞因子可以在C2C12細胞中誘導NF-κB活化,并且人TNF-α和IL-6對人和鼠細胞均有活性,我們測試了這兩種人細胞因子是否對C2C12肌管有影響。我們的結果證實,人TNF-α和IL-6能夠誘導小鼠肌管萎縮(圖6a,b),表明體外小鼠C2C12肌管模型可用于評估人類癌細胞誘導的癌癥惡病質。與從載體對照細胞暴露于CM的C2C12肌管的平均直徑相比,暴露于J82/HOTAIR細胞的CM的平均直徑較低(圖6c,d)。此外,順鉑處理進一步降低了暴露于J82細胞來源CM的C2C12肌管的平均直徑(圖6c,d)。除了檢查HOTAIR過表達后人J82細胞的CM外,我們還評估了Hotair的CRISPRi敲低后小鼠MBT-2細胞來源的CM對C2C12肌管萎縮的影響。與從J82細胞獲得的數據一致(圖6c,d),與培養基對照相比,用GFP敲低MBT-2細胞的CM處理顯著降低了C2C12肌管的平均直徑(圖6e,f)。值得注意的是,Hotair的敲低將肌管直徑恢復到暴露于培養基對照的對照細胞直徑的相似水平。此外,順鉑治療導致每次治療中肌管直徑的進一步減小。然而,在MBT-2細胞中敲低Hotair減輕了暴露于順鉑的MBT-2細胞CM誘導的肌管直徑減小。C2C12肌管測定的結果表明,人和小鼠膀胱癌細胞產生促進骨骼肌萎縮的因子,特別是在順鉑存在下。肌肉特異性E3泛素連接酶MuRF-1、UBR2(也稱為E3α-II)和趾激素-1在介導癌癥惡病質中肌肉蛋白的降解中起關鍵作用。因此,我們進一步檢查了這些E3泛素連接酶在用MBT-2細胞或其衍生物的CM處理的C2C12肌管中的表達。免疫印跡分析顯示,在用MBT-2或MBT-2/CSi-GFP細胞CM處理的細胞中,MuRF-1、UBR2和atrogin-1的表達增加。值得注意的是,Hotair的敲低減輕了MBT-2細胞CM誘導的MuRF-1,UBR2和atrogin-1的上調(圖6g,h)。綜上所述,使用C2C12肌管測定,我們證明HOTAIR在順鉑誘導的骨骼肌萎縮中起關鍵作用,這可能是通過上調萎縮相關的E3泛素連接酶介導的。
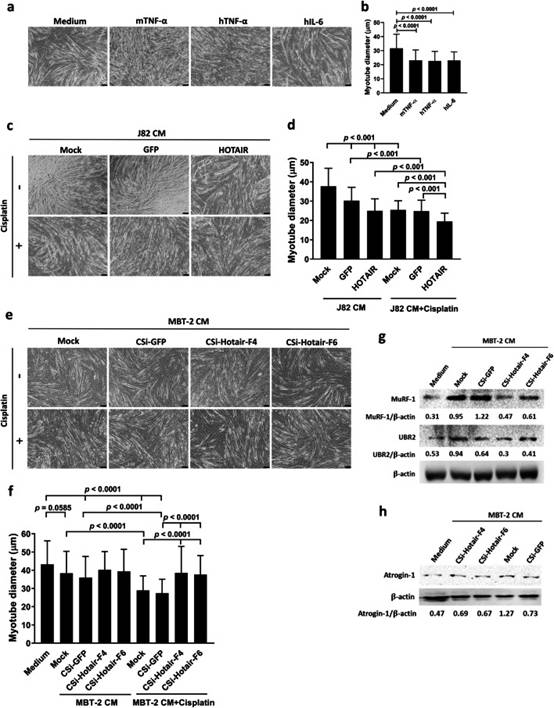
圖6 HOTAIR過度表達膀胱癌細胞的CM,特別是在順鉑存在下促進肌肉萎縮
7. 在膀胱腫瘤荷載小鼠中敲低Hotair可減弱順鉑誘導的癌癥惡病質
為了確認體外結果的相關性,我們使用同源MBT-2膀胱腫瘤模型來研究Hotair在小鼠腫瘤中的敲低是否可以改善接受順鉑化療的荷瘤小鼠的體重減輕和骨骼肌萎縮。協議時間表如圖7a所示。在植入MBT-2細胞的所有小鼠組中都注意到體重減輕(減去估計的腫瘤重量后)(圖7b)。在實驗結束時處死小鼠后計算相對體重變化(減去第0天絕對腫瘤重量/體重后的體重)。雖然攜帶MBT-2或MBT-2/CSi-GFP腫瘤的小鼠體重減輕超過20%,但與攜帶MBT-2/CSi-GFP腫瘤的小鼠相比,MBT-2腫瘤中Hotair的敲低顯著改善了荷瘤小鼠的體重減輕第29天(圖7c)。值得注意的是,腫瘤體積要小得多(圖7d),降低血清IL-6水平(圖7e)與健康小鼠相當,小腿周長更大(圖7f)在MBT-2/CSi-HOTAIR小鼠中檢測到,而不是在MBT-2/CSi-GFP攜帶小鼠中檢測到。關于骨骼肌萎縮,與MBT-2/CSi-GFP細胞相比,MBT-2/CSi-Hotair小鼠的腓腸肌肌纖維橫截面積明顯更厚(圖7g)。雖然從攜帶親本MBT-2或MBT-2/CSi-GFP腫瘤的小鼠獲得的肌肉組織表達升高的MuRF-1水平,但其表達在攜帶MBT-2/CSi-Hotair腫瘤的小鼠的肌肉組織中顯著降低(圖7h)。總之,這些結果表明順鉑治療可以誘導膀胱腫瘤小鼠的惡病質。更重要的是,沉默膀胱腫瘤中Hotair表達可以改善順鉑誘導的小鼠惡病質。總之,我們的動物研究提供了證據表明HOTAIR參與順鉑誘導的膀胱癌惡病質。
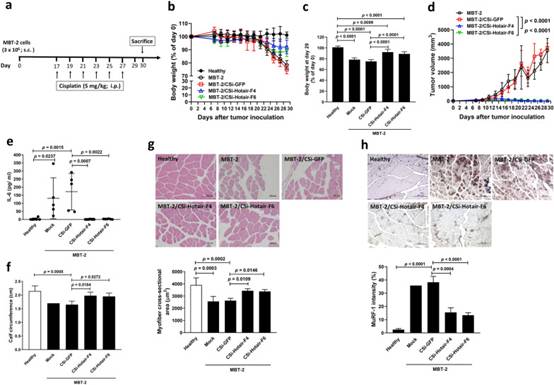
圖7 敲低MBT-2膀胱荷瘤小鼠中的Hotair可減輕順鉑誘導的癌癥惡病質
8. EGFR抑制劑厄洛替尼抑制腫瘤生長,但不能緩解順鉑誘導的膀胱腫瘤小鼠癌癥惡病質
鑒于吉非替尼和厄洛替尼消除了順鉑誘導的膀胱癌細胞中促炎細胞因子的上調(圖4f,g,h),我們接下來詢問厄洛替尼治療是否可以恢復順鉑誘導的體內惡病質。MBT-2腫瘤模型中的治療方案如圖8a所示。健康小鼠和未接受順鉑或厄洛替尼的攜帶MBT-2小鼠之間的體重沒有顯著差異(圖8b)。然而,接受順鉑但不接受厄洛替尼治療的荷瘤小鼠與接受載體(PBS)的小鼠相比體重較低。值得注意的是,厄洛替尼治療并沒有改善用順鉑治療的荷瘤小鼠的體重減輕。此外,用順鉑治療的荷瘤小鼠的小腿圍減少,厄洛替尼治療無法恢復(圖8c)。關于腫瘤大小,順鉑和厄洛替尼聯合治療顯著減少了小鼠的腫瘤體積,而順鉑或厄洛替尼的單次治療對抑制腫瘤生長沒有影響(圖8d)。總之,與單次使用順鉑或厄洛替尼治療相比,厄洛替尼治療與順鉑聯合用于膀胱荷瘤小鼠顯著減小腫瘤大小。此外,我們的結果表明,順鉑治療誘導體重減輕,厄洛替尼對緩解膀胱腫瘤小鼠體重減輕和骨骼肌萎縮沒有影響。
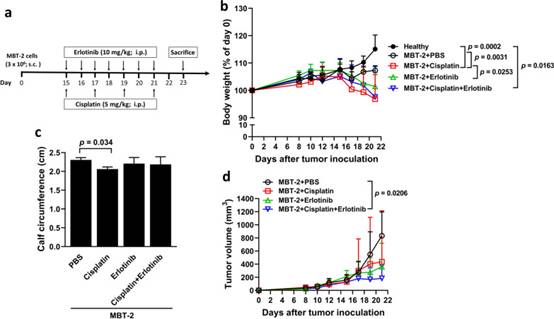
圖8 厄洛替尼治療抑制腫瘤生長,但不能緩解MBT-2膀胱腫瘤小鼠順鉑誘導的癌癥惡病質
結論:
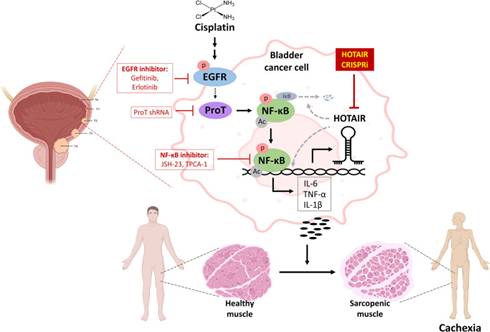
該研究證明了HOTAIR在順鉑誘導的膀胱癌惡病質中的關鍵作用,并將HOTAIR確定為膀胱癌和其他可能癌癥惡病質的新治療靶點。盡管其他基因或信號通路參與順鉑誘導的膀胱癌惡病質不容忽視,但EGFR-ProT-NF-κB-HOTAIR信號軸的組分代表了預防或改善順鉑誘導的膀胱癌和其他癌癥惡病質的新治療策略的靶標。
示意圖:
參與順鉑誘導的癌癥惡病質的EGFR / ProT / NF-κB / HOTAIR軸的示意圖:
參考文獻:
Hu CY, Su BH, Lee YC, Wang CT, Yang ML, Shen WT, Fu JT, Chen SY, Huang WY, Ou CH, Tsai YS, Kuo FC, Shiau AL, Shieh GS, Wu CL. Interruption of the long non-coding RNA HOTAIR signaling axis ameliorates chemotherapy-induced cachexia in bladder cancer. J Biomed Sci. 2022 Dec 6;29(1):104. doi: 10.1186/s12929-022-00887-y.






