lncRNA RGMB-AS1通過抑制HMOX1泛素化和NAA10激活來誘導非小細胞肺癌中的鐵死亡
鐵死亡是一種由過量脂質過氧化積累引起的鐵依賴性調節細胞死亡方式,已逐漸成為包括非小細胞肺癌(NSCLC)在內的多種癌癥的有希望的治療靶點。在這項研究中,我們確定了lncRNA RGMB-AS1作為NSCLC中鐵死亡的關鍵調節因子。機制上,RGMB-AS1與HMOX1相互作用,防止其被E3連接酶TRC8泛素化,導致HMOX1穩定性增加和鐵死亡增強。此外,RGMB-AS1結合到NAA10的82-87氨基酸區域,刺激其乙酰轉移酶活性,促進乙酰-CoA向HMG-CoA的轉化,進一步貢獻于鐵死亡。RGMBAS1-HMOX1和RGMB-AS1-NAA10軸協同抑制了NSCLC在體內和體外的生長。臨床上,NSCLC患者中低RGMB-AS1表達與腫瘤分期晚和總體生存率差有關。此外,腺相關病毒介導的RGMB-AS1過表達顯著抑制了小鼠異種移植模型中的腫瘤生長。我們的發現揭示了鐵死亡的一種新的lncRNA介導的調控機制,并強調了RGMB-AS1作為NSCLC預后生物標志物和治療靶點的潛力。本文于2024年4月發表于“Cancer Letters”(IF=9.7)上。
技術路線
結果:
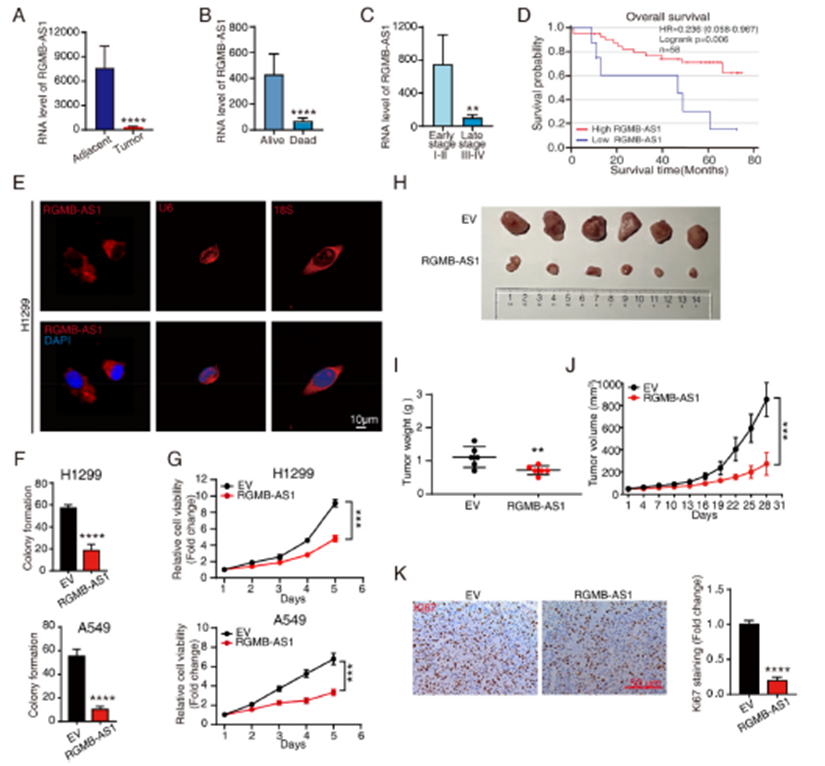
1)低水平的RGMB-AS1與非小細胞肺癌的預后不良和體內外的腫瘤進展有關
為了探討RGMB-AS1與非小細胞肺癌臨床結果的相關性,我們收集了58名患者的非小細胞肺癌組織樣本和匹配的正常肺組織樣本。我們發現,與正常肺組織相比,腫瘤中RGMB-AS1的表達顯著降低(圖1A)。死于非小細胞肺癌的患者RGMB-AS1的水平顯著低于存活的患者(圖1B),且RGMB-AS1的低水平與晚期TNM分期(III-IV期)顯著相關(圖1C)。Kaplan-Meier生存曲線顯示,低水平的RGMB-AS1預示著非小細胞肺癌患者總生存期(OS)不良(圖1D)。H1299細胞中的熒光原位雜交(FISH)結果顯示,RGMB-AS1主要定位于細胞質(圖1E)。RGMB-AS1的過表達導致克隆形成能力降低和細胞活力減少(圖1F-G)。為了進一步評估RGMB-AS1與非小細胞肺癌細胞增殖之間的關聯性,我們在裸鼠皮下注射RGMB-AS1過表達的H1299穩定細胞來評估腫瘤生長。RGMB-AS1的過表達顯著抑制了腫瘤生長(圖1H-J)。兩組腫瘤的免疫組化染色進一步證實,過表達RGMB-AS1的腫瘤顯示Ki-67的水平降低(圖1K)。
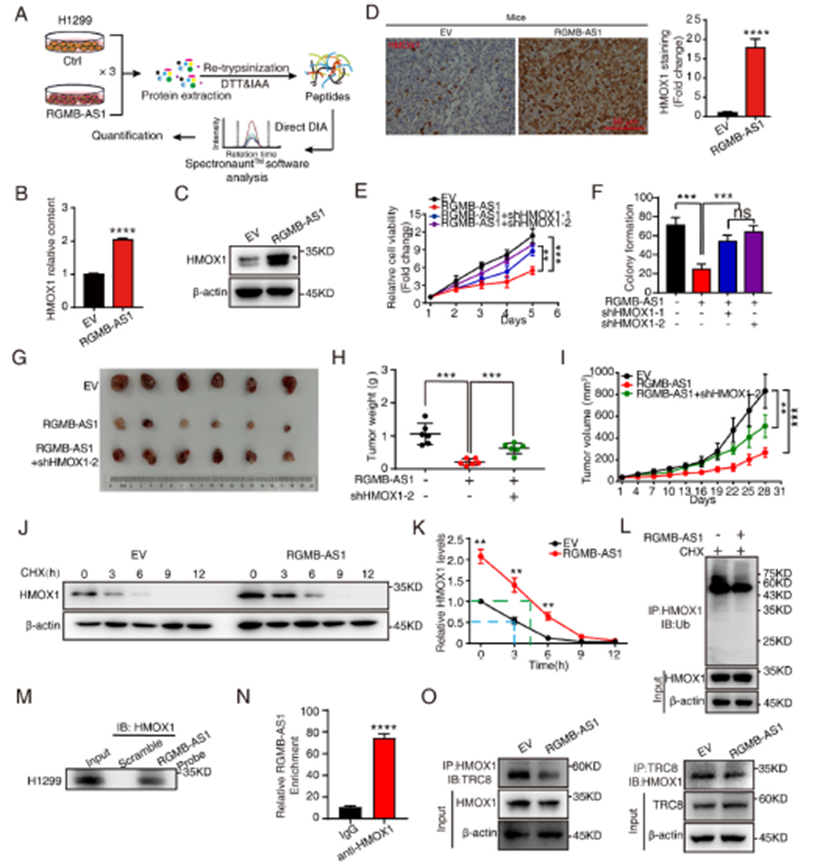
2)RGMB-AS1與HMOX1相互作用,抑制HMOX1泛素化
為了探討RGMB-AS1抑制非小細胞肺癌增殖的潛在機制,我們進行了基于DIA(數據獨立采集)的蛋白質組學分析,以比較RGMB-AS1過表達細胞與對照細胞之間的蛋白質變化。在RGMB-AS1過表達引起的321個差異表達蛋白(DEPs)中,HMOX1受到的影響最為顯著。RGMB-AS1的過表達導致HMOX1蛋白水平增加(圖2C)。一致地,RGMB-AS1過表達組小鼠腫瘤中HMOX1的蛋白水平增加(圖2D)。使用shRNA在RGMB-AS1過表達穩定細胞中敲低HMOX1,導致細胞活力和克隆形成能力增加(圖2E和F)。與細胞結果一致,裸鼠體內實驗也顯示,使用shRNA敲低HMOX1削弱了RGMB-AS1過表達對腫瘤進展的影響(圖2G-I)。然后我們調查RGMB-AS1如何調節HMOX1蛋白水平。CHX追蹤實驗的證據顯示,RGMB-AS1顯著增加了HMOX1的蛋白穩定性(圖2J和K)。我們進一步評估了HMOX1的泛素化,并發現RGMB-AS1過表達導致HMOX1泛素化水平降低(圖2L)。TRC8,一種E3泛素連接酶,被發現促進HMOX1的泛素化并抑制癌細胞生長。RGMB-AS1拉下實驗能共同拉下HMOX1(圖2M),HMOX1 RNA免疫沉淀(RIP)也富集了RGMB-AS1(圖2N),進一步證實了這種相互作用。值得注意的是,RGMB-AS1過表達破壞了HMOX1與TRC8的相互作用,表明RGMB-AS1通過減輕TRC8介導的泛素化來促進HMOX1的穩定性(圖2O)。綜上所述,RGMB-AS1與HMOX1相互作用,并競爭性抑制TRC8與HMOX1的結合,從而抑制其泛素化。
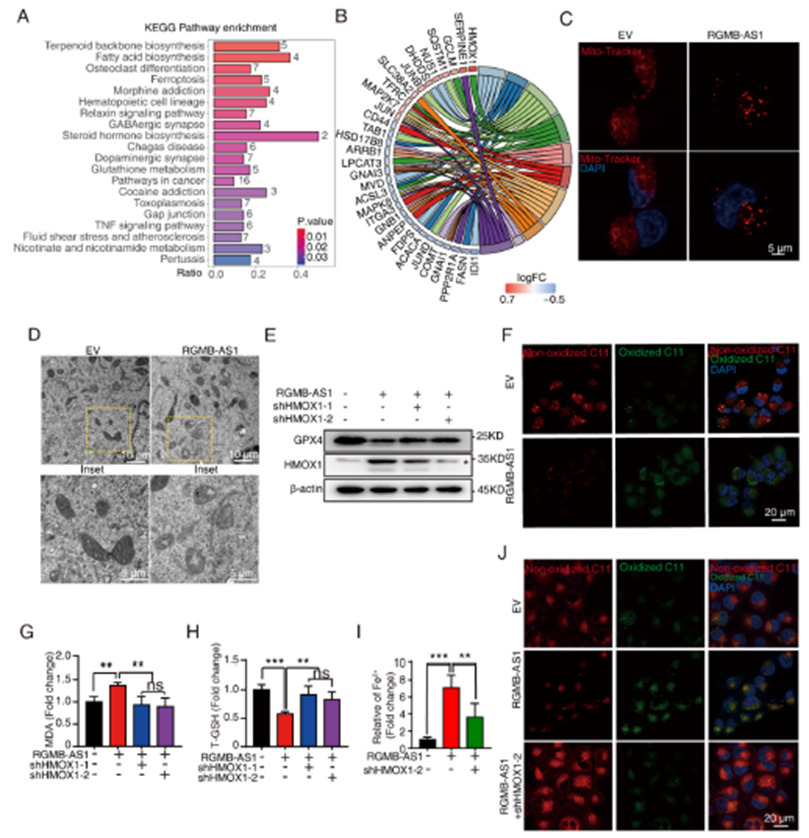
3)RGMB-AS1-HMOX1促進肺癌鐵死亡
為了探討RGMB-AS1-HMOX1參與的關聯途徑,我們進行了KEGG分析,結果顯示,差異表達基因在脂肪酸生物合成、鐵死亡和GSH代謝等途徑中富集(圖3A),在鐵死亡途徑中,與RGMB-AS1相互作用的HMOX1是五個富集基因中差異表達最顯著的(圖3B)。為了確定RGMB-AS1-HMOX1相互作用是否參與鐵死亡,我們首先使用Mito-Tracker Red觀察了線粒體完整性。與對照細胞相比,RGMB-AS1過表達顯示出異常的線粒體分布(圖3C)。透射電子顯微鏡(TEM)觀察發現,RGMB-AS1過表達導致線粒體膜密度增加和線粒體脊減少(圖3D)。GPX4水平在RGMB-AS1過表達時降低,而進一步敲低HMOX1的shRNA則逆轉了這些效應(圖3E)。RGMB-AS1過表達導致脂質ROS水平增加(圖3F)。我們檢測了MDA的水平,它是脂質過氧化物的最終產物,以及總GSH的水平,它是抵抗鐵死亡的關鍵抗氧化劑。結果顯示,RGMB-AS1過表達導致MDA水平增加和總GSH水平降低,進一步敲低HMOX1則逆轉了這些效應(圖3G和H)。同時,我們還檢測了小鼠異種移植組織中的Fe2+水平。Fe2+水平在RGMB-AS1過表達組增加,但在HMOX1敲除后可以逆轉(圖3I)。一致地,RGMB-AS1敲除細胞中的脂質ROS水平顯著降低,在此基礎上過表達HMOX1可以恢復脂質ROS水平(圖3J)。綜上所述,這些結果表明RGMB-AS1通過與HMOX1共同作用來促進鐵死亡。
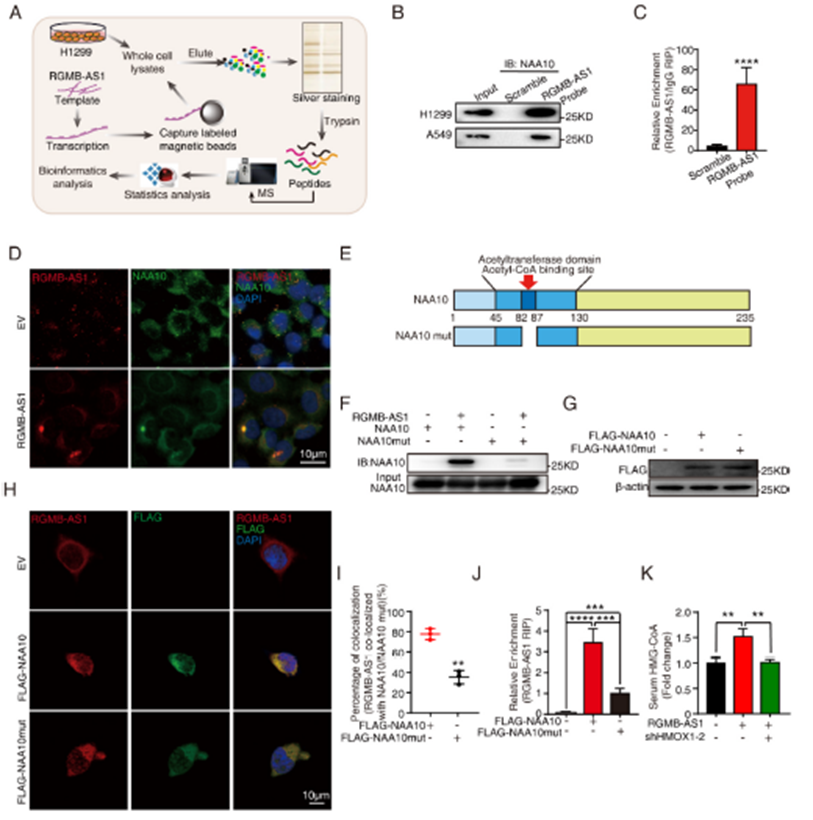
4)RGMB-AS1與NAA10結合促進NAA10活性
為了進一步探討RGMB-AS1在促進肺癌細胞鐵死亡中的作用,我們在非交聯條件下進行了RGMB-AS1拉下實驗,隨后進行質譜分析以直接鑒定蛋白質(圖4A)。在H1299和A549細胞中,通過體外轉錄的RGMB-AS1 RPD-MS結果,NAA10是肽段數量和序列覆蓋率(11%)最高的前五個蛋白質之一。RGMB-AS1拉下實驗能夠共同拉下NAA10(圖4B),NAA10 RNA免疫沉淀(RIP)也富集了RGMB-AS1(圖4C),進一步證實了這種相互作用。通過RGMB-AS1的熒光原位雜交(FISH)和針對NAA10蛋白的免疫熒光(IF)染色,顯示它們可能有一些機會相互作用(圖4D)。為了進一步研究RGMB-AS1-NAA10相互作用,我們檢查了NAA10與RGMB-AS1結合時的相互作用區域。通過刪除NAA10的乙酰輔酶A結合位點(RRLGLA),這是其乙酰轉移酶酶活性至關重要的一步(圖4E),我們進行了RGMB-AS1的體外轉錄和NAA10(NAA10突變體)的原核蛋白純化實驗。我們發現,在RGMB-AS1拉下實驗中,NAA10乙酰輔酶A結合位的刪除(NAA10突變體)削弱了RGMB-AS1與NAA10的結合(圖4F)。一致地,針對FLAG標簽的RGMB-AS1 FISH和IF染色顯示,RGMB-AS1與NAA10的共定位減少(圖4G-I)。針對FLAG標簽的NAA10 RIP和NAA10突變體過表達實驗顯示,乙酰輔酶A結合位的刪除削弱了NAA10與RGMB-AS1的結合(圖4J)。在RGMB-AS1過表達的腫瘤攜帶小鼠中觀察到HMG-CoA水平增加,基于此敲低HMOX1可以恢復HMG-CoA水平(圖4K)。綜合這些結果表明,RGMB-AS1可以通過關鍵的乙酰輔酶A結合位點(RRLGLA)與NAA10結合,并通過促進乙酰輔酶A到HMG-CoA的轉換來增加NAA10的活性。
5)RGMB-AS1通過調節NAA10活性促進鐵死亡
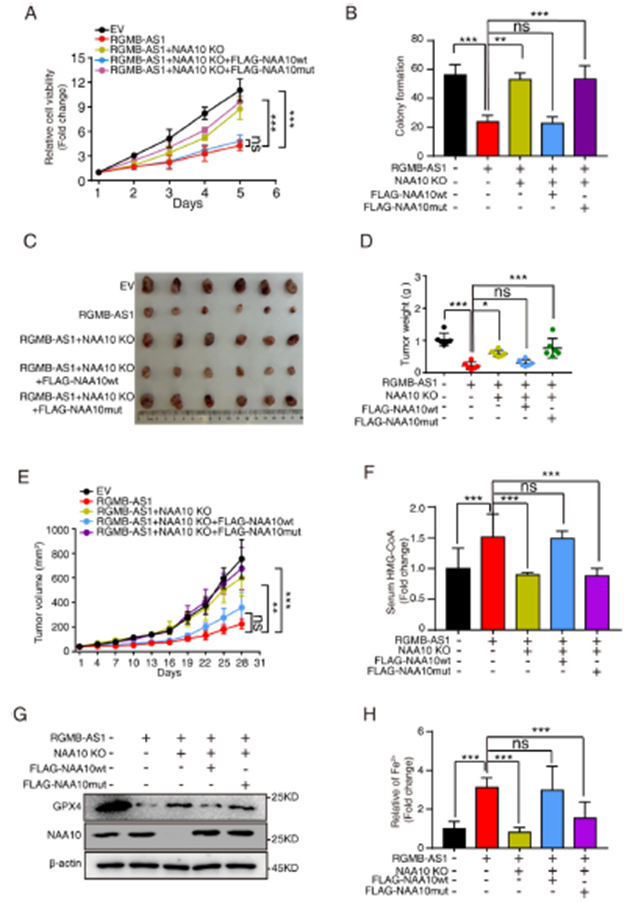
我們探討了RGMB-AS1-NAA10軸在腫瘤進展中的作用。使用CRISPR/Cas9技術在H1299 RGMB-AS1過表達細胞中生成NAA10。NAA10敲除促進了RGMB-AS1過表達細胞中的細胞活力和集落形成,而額外的FLAG標簽野生型NAA10過表達,而不是其突變體,恢復了這種效果(圖5A和B)。同樣,裸鼠皮下注射實驗顯示,RGMB-AS1過表達時的NAA10敲除促進了腫瘤生長,增加了腫瘤重量和Ki-67水平,而野生型NAA10過表達,但不是其突變體,恢復了這些效果(圖5C-E)。在RGMB-AS1過表達細胞中敲除NAA10逆轉了RGMB-AS1過表達引起的HMG-CoA水平增加。另一方面,野生型NAA10過表達,但不是其突變體,再次增加了總血清NAA10和HMG-CoA水平(圖5F)。我們探討了RGMB-AS1-NAA10軸是否調節鐵死亡。在RGMB-AS1過表達細胞中敲除NAA10后,GPX4水平增加,Fe2+水平降低,表明RGMB-AS1-NAA10也參與調節鐵死亡(圖5G和H)。綜合來看,RGMB-AS1與NAA10的相互作用對于體外和體內腫瘤進展至關重要,RGMB-AS1-NAA10可能通過與HMG-CoA相關的鐵死亡發揮作用。
6)RGMB-AS1 通過依賴于HMOX1和NAA10的促進鐵死亡機制抑制腫瘤進展
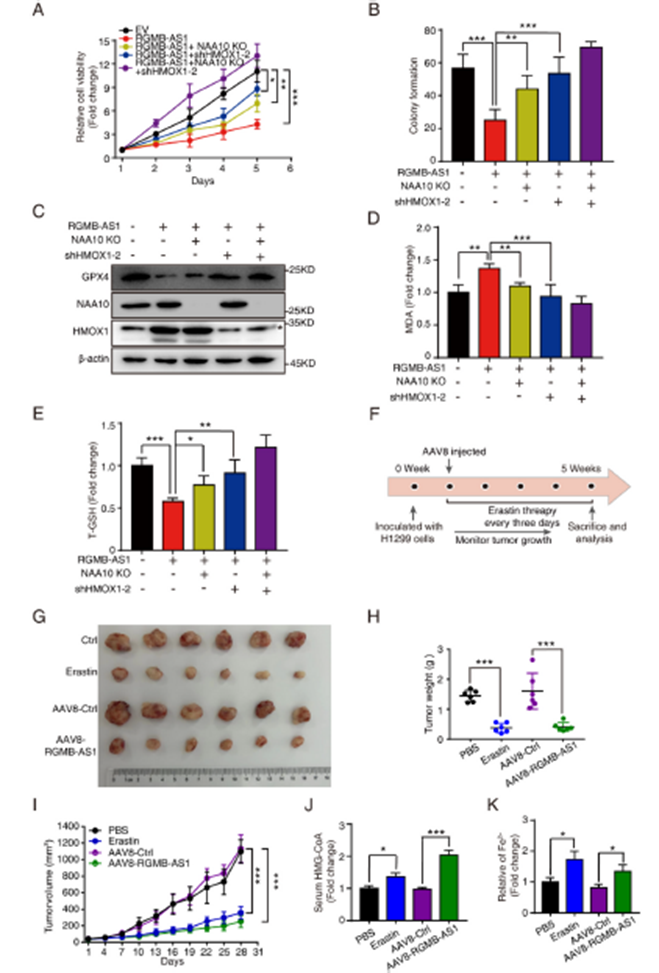
為了進一步深入了解RGMB-AS1調控HMOX1和NAA10以增強肺癌鐵死亡分子機制,我們分別通過敲除NAA10、shRNA敲低HMOX1以及將兩者結合的方式,在RGMB-AS1過表達細胞中評估了細胞活力和集落形成。結果顯示,NAA10敲除和HMOX1敲低均部分逆轉了RGMB-AS1過表達的效果,而它們的組合具有最顯著的逆轉效果(圖6A和B)。在RGMB-AS1調節鐵死亡的過程中,我們也觀察到NAA10敲除和HMOX1敲低均部分削弱了鐵死亡,它們的組合具有最顯著的效果,恢復了GPX4、MDA和總GSH水平(圖6C-E)。為了評估RGMB-AS1介導的鐵死亡在體內的效果,我們向4周齡的裸鼠體內注射了表達RGMB-AS1的AAV8(AAV8-RGMB-AS1)或相應的對照(AAV8-Ctrl)。在感染5周后進行檢查,AAV8-RGMB-AS1導致腫瘤生長受到抑制。使用鐵死亡誘導劑Erastin進一步評估RGMB-AS1在鐵死亡中的功能。用Erastin(30 mg/kg)每隔三天治療腫瘤攜帶小鼠5周,也導致腫瘤生長顯著抑制,與AAV8-RGMB-AS1治療結果相當(圖6F-I)。AAV-RGMB-AS1和Erastin處理后HMG-CoA顯著增加(圖6J)。同時,通過鐵測定評估腫瘤異種移植物中Fe2+水平,結果顯示AAV-RGMB-AS1和Erastin處理均顯著增加了Fe2+水平(圖6K)。這些結果表明RGMB-AS1是抑制肺癌腫瘤進展的關鍵因素,通過HMOX1和NAA10分別介導的兩種途徑誘導鐵死亡。
結論:
我們揭示了RGMB-AS1介導的RGMB-AS1-HMOX1和RGMB-AS1-NAA10軸在非小細胞肺癌進展中誘導鐵死亡的作用。更好地理解RGMB-AS1在生物學過程中的關鍵角色可能會導致新的癌癥治療策略。
實驗方法:
CCK8、克隆形成實驗、質譜、WB、pull down、qRT-PCR、Co-IP、FISH、RIP、脂質過氧化測定、腫瘤異種移植實驗、ELISA、免疫組化、TEM。
參考文獻:
Gao GB, Chen L, Pan JF, Lei T, Cai X, Hao Z, Wang Q, Shan G, Li J. LncRNA RGMB-AS1 inhibits HMOX1 ubiquitination and NAA10 activation to induce ferroptosis in non-small cell lung cancer. Cancer Lett. 2024 Apr 2;590:216826. doi: 10.1016/j.canlet.2024.216826.






