乳腺癌轉移新機制的關鍵信號分子——ActA
盡管人們對乳腺癌已經進行了廣泛的研究,但乳腺癌仍然是造成女性死亡的主要癌癥之一,也是女性中最常見的癌癥。乳腺癌的死亡率幾乎完全是腫瘤轉移的結果。轉移性癌癥在很大程度上是無法治愈的,是癌癥相關死亡的主要原因。轉移性微環境有利于轉移灶的形成。癌癥相關成纖維細胞(CAFs)是通過介導炎癥微環境產生適宜轉移生態位的關鍵參與者。成纖維細胞在改變細胞外基質(ECM)的結構和硬度方面也起著核心作用。解決轉移生態位的早期變化可以幫助確定抑制轉移進展的方法。作者在小鼠自發性乳腺癌肺轉移模型中證明,肺成纖維細胞的纖維化改變和重新布線發生在轉移前階段,表明原發腫瘤的全身性影響。激活素A (ActA)是TGFβ超家族成員,從乳腺腫瘤中分泌,其在荷瘤小鼠血液中的水平高度升高。ActA上調肺成纖維細胞中促纖維化因子的表達,導致肺轉移前生態位膠原沉積增強。ActA信號在肺轉移中具有重要的功能,因為在乳腺癌細胞中靶向ActA可顯著減輕肺轉移并提高生存率。該文章于2023年10月發表在《Cancer Research》,IF: 11.2。
技術路線
技術路線圖
主要研究結果
1. 肺轉移與膠原沉積增加有關,從轉移前生態位開始
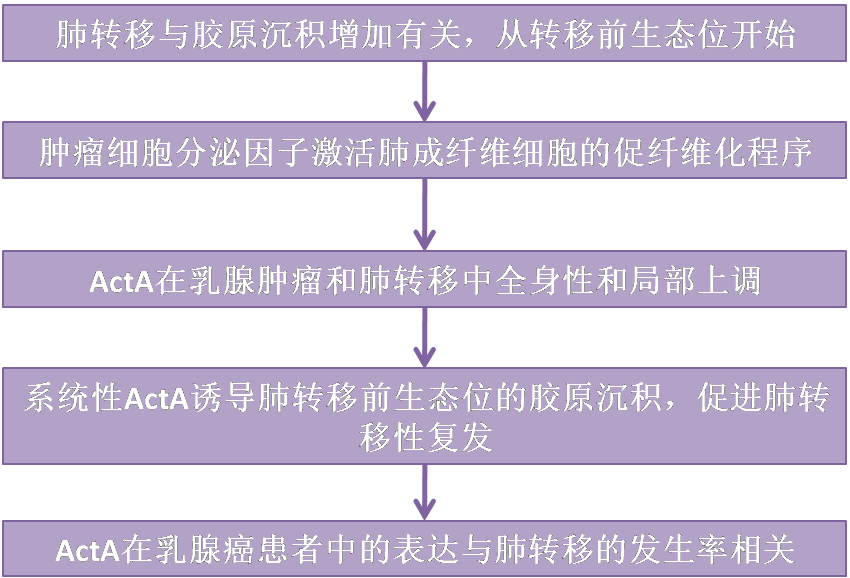
作者之前分析了肺轉移不同階段與轉移相關的成纖維細胞的轉錄組,發現它們激活了與ECM重塑和膠原沉積相關的基因程序。因此,作者著手研究這些基因程序如何在轉移生態位的肺成纖維細胞中被激活,以及它們如何影響乳腺癌的轉移性復發。作者首先分析了MMTV-PyMT小鼠肺中的膠原沉積,MMTV-PyMT是一種發生自發肺轉移的乳腺癌模型。與FVB/n對照小鼠的正常肺相比,使用二次諧波生成(SHG)顯微鏡觀察轉移性MMTV-PyMT肺中的纖維膠原(圖1A)。為了量化腫瘤誘導的膠原纖維組織變化,作者使用了TWOMBLI插件。分析顯示,在有轉移的肺中,膠原纖維的面積、長度和密度明顯更高(圖1B)。有趣的是,先前有報道稱,在比較正常乳腺和乳腺腫瘤時,纖維取向從各向同性變為各向異性。作者的研究結果表明,與原發腫瘤相比,不同的ECM調節機制在轉移部位起作用。膠原纖維Picrosirius Red染色定量證實,荷瘤小鼠肺中膠原沉積明顯增加(圖1C,D)。此外,肺部纖維化區域的評分顯示,MMTV-PyMT小鼠的肺部與對照組相比,高評分纖維化區域的發生率更高(圖1E)。為了證實這些發現不是模型特異性的,作者還分析了轉移到肺部的三陰性乳腺癌(4T1癌細胞)可移植模型中的膠原沉積。該分析證實,與正常BALB/c對照小鼠相比,注射4T1后肺轉移小鼠肺內膠原沉積明顯增多(圖1F-H)。因此,肺轉移與肺纖維化有關。
考慮到作者之前在肺轉移不同階段的成纖維細胞轉錄組數據的發現表明膠原沉積的變化是一個早期事件,作者接下來研究了肺轉移過程中纖維化變化的時間。因此,作者分析了MMTV-PyMT小鼠在腫瘤進展的不同階段肺中的膠原含量。與乳腺增生(7-8周齡,未形成明顯轉移灶)或轉移癌(14-16周齡)的MMTV-PyMT小鼠肺相比,正常肺的馬氏三色顯示,早在肺轉移發生前的增生性階段,肺膠原沉積就發生了顯著變化(圖1 - l)。有趣的是,與正常相比,膠原沉積的增強在乳腺增生小鼠的轉移前肺中最為明顯(圖1J,L),進一步表明纖維化變化是在可檢測的轉移病變形成之前的早期事件。
2.腫瘤細胞分泌因子激活肺成纖維細胞的促纖維化程序
接下來,作者著手研究肺中膠原沉積的增強是否與體內荷瘤小鼠肺成纖維細胞中促纖維化基因程序的激活有關。為了能夠無偏分離成纖維細胞,作者將MMTV-PyMT小鼠模型與在膠原-1a啟動子(Col1a1-YFP)下表達熒光報告基因YFP的轉基因小鼠雜交,建立了所有成纖維細胞都被熒光標記的PyMT;Col1a1-YFP轉基因小鼠。用流式細胞術從正常Col1a1-YFP小鼠肺、乳腺增生(轉移前)的Col1a1-YFP小鼠肺或轉移小鼠肺中分離肺成纖維細胞。有趣的是,表達分析顯示,從前轉移性肺分離的肺成纖維細胞中,促纖維化基因的表達已經上調(Pre-Met LFs;圖2A),與正常肺成纖維細胞(NLFs)以及轉移相關成纖維細胞(MAFs)相比,從轉移肺中分離出來(圖2C)。作者將結果整合到由Col1a1、Acta2、Ctgf、Lox、Loxl2、Sparc和Serpine1聯合表達組成的“纖維化評分”中,并證實肺Pre-Met LFs和MAFs都以促纖維化基因程序的激活為特征(圖2B, D)。
由于在彌散性腫瘤細胞定植之前,乳腺癌早期就出現了肺部膠原沉積的增加,因此作者假設肺成纖維細胞的促纖維化激活可能是由原發腫瘤分泌的因子通過系統性信號傳導引起的,從而誘導形成一個適宜的纖維化轉移前生態位。為了驗證這一假設,作者首先分析了與源自PyMT腫瘤的Met-1細胞分泌因子孵育的NLFs中促纖維化基因特征的表達。該分析顯示,與對照組相比,激活的NLFs中多個促纖維化基因的表達明顯上調(圖2E,F)。由于已知TGF-β信號在傷口愈合、纖維化和腫瘤進展的結締組織增生反應中對誘導膠原沉積起重要作用,作者還測試了TGF-β信號是否在與癌細胞分泌因子一起培養的NLFs中被激活。事實上,NLFs與腫瘤細胞條件培養基(CM)孵育導致SMAD2和SMAD3磷酸化增加,表明腫瘤分泌因子激活了典型的TGF-β信號通路(圖2G)。為了評估腫瘤分泌因子是否通過系統性信號傳導影響轉移前生態位的肺成纖維細胞,作者分析了荷瘤小鼠血液中分泌因子對肺成纖維細胞活化的影響。將NLFs與荷瘤MMTV-PyMT小鼠或正常FVB/n小鼠的血漿孵育(圖2H),并分析促纖維化基因特征的表達。作者發現MMTV-PyMT小鼠血漿中的因子上調了正常肺成纖維細胞中促纖維化基因的表達(圖2I)。
作者接下來研究腫瘤分泌因子是否影響成纖維細胞膠原的生成和沉積。為了驗證這一點,NLFs與腫瘤細胞分泌因子或對照無血清培養基(SFM)孵育,并允許生成細胞衍生基質(CDM)。成纖維細胞來源的膠原基質的SHG成像顯示,與腫瘤細胞CM孵育的NLFs相比,與SFM孵育的NLFs產生了更致密的膠原基質(圖2J-L)。綜上所述,這些結果表明,肺成纖維細胞被腫瘤分泌因子激活,通過SMAD信號通路上調促纖維化基因的表達,增加膠原沉積。
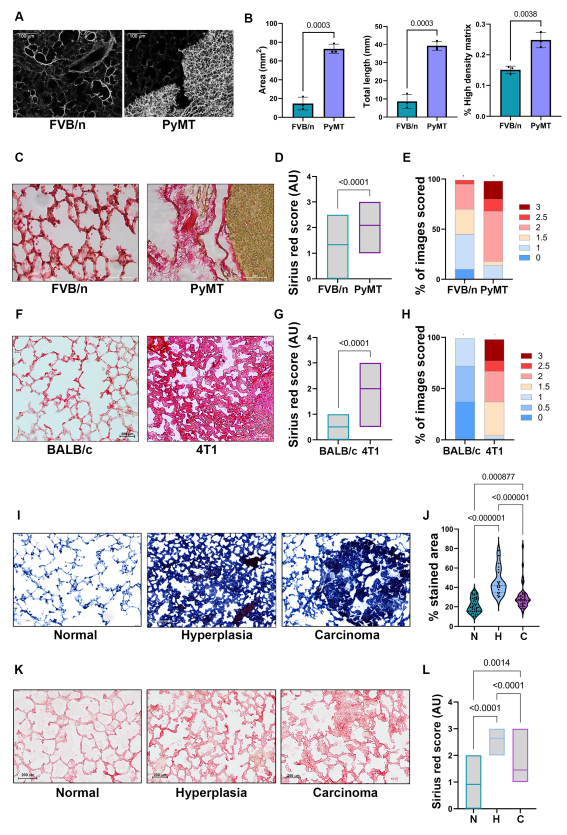
圖1 乳腺癌的進展與肺部膠原沉積增強有關
3. ActA在乳腺腫瘤和肺轉移中全身性和局部上調
為了確定可能參與肺成纖維細胞活化的全身性腫瘤分泌因子,作者對正常FVB/n小鼠和荷瘤MMTV-PyMT小鼠的血漿進行了蛋白質組學分析(圖3A)。作者在蛋白質陣列中確定了MMTV-PyMT小鼠血漿中上調最多的50種蛋白質,并使用VarElect工具對其進行了進一步分析,該工具可以對與特定查詢條件相關的基因進行優先排序。使用“膠原合成”作為關鍵詞的分析在高分基因中確定了抑制素β A (INHBA)(圖3B)。編碼蛋白INHBA是一個亞基,可以與抑制素家族的其他亞基二聚形成功能二聚體,其中一個是激活素a(ActA),一個由兩個INHBA亞基組成的二聚體。激活蛋白是TGF-β超家族配體的成員,是已知的纖維化激活因子,因此作者決定進一步研究ActA。

圖2 腫瘤激活的肺成纖維細胞表達促成纖維基因并表現出膠原沉積增加
分泌的ActA先前參與促進腫瘤進展和纖維化疾病,并被證明通過SMAD2/3信號通路激活Col1α和其他纖維化相關基因的表達。因此,作者開始評估乳腺癌進展過程中ActA水平的變化。與荷瘤MMTV-PyMT小鼠相比,正常FVB/n小鼠血漿中ActA水平的分析證實,荷瘤小鼠中ActA水平顯著升高(圖3C)。此外,對單個小鼠血漿樣本的縱向分析顯示,ActA水平隨著疾病進展而增加(圖3D)。對正常FVB/n小鼠和荷瘤MMTV-PyMT小鼠乳腺和肺組織中ActA水平的分析進一步證實,荷瘤小鼠兩組織中ActA水平均顯著高于對照組(圖3E,F)。
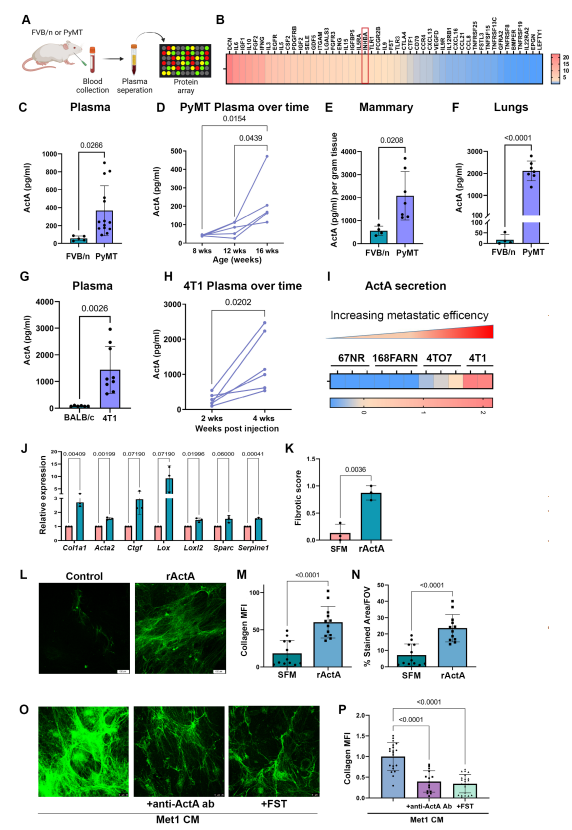
圖3 循環ActA水平隨著疾病進展而增加
MMTV-PyMT是一種小鼠腔內乳腺癌模型。為了測試ActA的上調是否在其他乳腺癌類型中是一個普遍的機制,作者分析了注射4T1細胞的荷瘤小鼠血漿中ActA的水平。作者發現,與正常BALB/c小鼠相比,原位注射4T1細胞的小鼠血漿中ActA水平升高(圖3G),證實該途徑在多種乳腺癌亞型中有效。此外,小鼠的縱向隨訪表明,在可移植模型中,血漿ActA水平也隨著疾病的進展而升高(圖3H)。
4T1細胞最初是作為一系列轉移效率增加的細胞系的一部分建立的,從67NR(非轉移)到4T1(高度轉移)。有趣的是,在包含4T1細胞系系列質譜數據的公開數據集中對ActA分泌水平的分析顯示,ActA分泌增加與轉移能力相關(圖3I),進一步表明ActA在支持轉移進展中的作用。
為了評估ActA是否足以誘導肺成纖維細胞的促纖維化信號,作者將外源性ActA孵育NLFs,并分析其促纖維化基因特征的表達。結果表明,ActA誘導了NLFs中促纖維化基因特征的表達(圖3J,K)。此外,與SFM培養的NLFs相比,ActA培養的NLFs產生的CDM顯示出更密集的膠原沉積(圖3L-N)。為了進一步評估ActA是否有必要增強肺成纖維細胞的膠原沉積,作者用MMTV-PyMT癌細胞分泌因子(Met-1 CM)或Met-1 CM補充ActA的中和抗體或外源性Follistatin (Fst) (ActA的天然拮抗劑)培養NLFs。分析結果顯示,當ActA被抑制時,活化的成纖維細胞的膠原沉積顯著減少(圖3O,P),證實了ActA對于成纖維細胞的促纖維化活化是必要的。
綜上所述,這些數據表明,在荷瘤小鼠中,原發性乳腺腫瘤分泌的ActA在局部和全身都有所增加,其水平與腫瘤的進展和轉移有關。此外,這些發現表明,在肺成纖維細胞中,腫瘤介導的成纖維信號的誘導是由ActA的分泌促進的。
4. 系統性ActA誘導肺轉移前生態位的膠原沉積,促進肺轉移性復發
為了評估ActA在誘導肺纖維化轉移前生態位中的功能作用,作者使用shRNA轉導降低了其在4T1癌細胞中的表達。作者使用了兩個單獨的敲低(KD) shrna (shActA)和一個亂序控制結構(shScr)。qRT-PCR在mRNA表達水平和ELISA在蛋白分泌水平均證實了ActA的表達KD(圖4A,B)。作者初步分析了ActA的KD是否影響原發腫瘤的生長。對原位注射腫瘤的分析顯示,雖然ActA KD腫瘤的生長與對照腫瘤相比略有減少(圖4C),但在切除時腫瘤體積沒有顯著差異(圖4D)。接下來,作者研究了ActA是否對成纖維細胞激活和早期肺中的膠原沉積具有重要的功能,從而產生纖維化轉移前生態位。作者將4T1 ActA KD細胞原位注射到Col1a1啟動子下表達YFP的轉基因BALB/c小鼠的乳腺中,以促進使用FACS從轉移前肺中分離肺成纖維細胞。原位注射后3周,在大轉移灶形成之前采集肺(圖4E)。值得注意的是,與從對照腫瘤小鼠分離的成纖維細胞相比,原發腫瘤中ActA的KD導致肺成纖維細胞中原纖維化基因的表達急劇降低(由聯合纖維化評分確定)(圖4F)。同樣,通過YFP+細胞的平均熒光強度測量,在KD腫瘤小鼠的肺成纖維細胞中,Col1a1啟動子激活顯著降低(圖4G),暗示ActA信號在肺成纖維細胞的促纖維化激活中起作用。此外,肺組織切片膠原的Masson三色染色證實,與對照腫瘤小鼠相比,ActA KD顯著減少了ActA KD腫瘤小鼠肺部膠原沉積(圖4H,I)。因此,來自原發腫瘤的系統性ActA在轉移前肺中激活肺成纖維細胞向纖維化前表型發展,導致膠原表達和沉積增加。
最后,作者通過對注射ActA KD細胞或對照小鼠進行分析,研究了ActA信號在原發性乳腺腫瘤手術切除后促進肺轉移性復發中的功能作用(圖5A)。在腫瘤切除前不久和切除后2周抽取血樣。雖然血液中殘留的ActA表明其他宿主細胞也對全身ActA有貢獻,但切除原發腫瘤足以顯著降低其血液水平,表明原發腫瘤確實是全身ActA的主要來源(圖5B)。值得注意的是,在對照組中,一些小鼠在腫瘤切除兩周后血液中ActA水平升高,這表明新出現的肺轉移可能已成為系統性ActA的來源。
為了評估ActA抑制對肺轉移負荷的影響,作者通過CT成像進行了肺內轉移進展成像。原發腫瘤切除兩周后的轉移負荷分析表明,注射shActA癌細胞的小鼠轉移負荷和發病率顯著降低(圖5C-E)。在每只小鼠死于轉移性疾病的終末期,肺組織切片的轉移負荷量化顯示,注射shActA癌細胞的小鼠轉移減少的趨勢類似,但沒有達到顯著性(圖5F,G)。重要的是,與它們的轉移進展減弱一致,注射ActA KD腫瘤細胞的小鼠的存活率顯著提高(圖5H)。此外,腫瘤切除前循環中的ActA水平與生存時間呈負相關(圖5I)。這些發現證實了腫瘤來源的ActA,作者已經證明它可以誘導纖維化的轉移前生態位,在促進肺轉移中具有重要的功能,從而降低生存率。
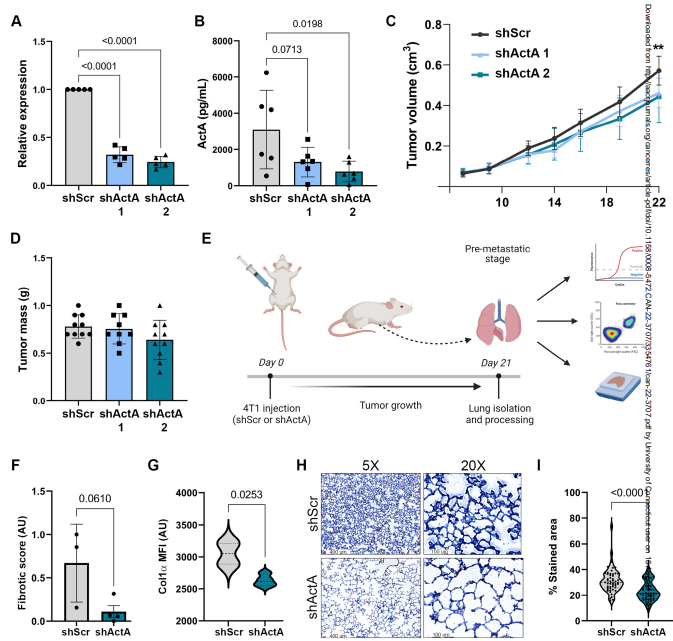
圖4 ActA的KD抑制肺轉移前生態位的ECM重塑
5. ActA在乳腺癌患者中的表達與肺轉移的發生率相關
為了評估ActA在人類乳腺癌轉移中的作用,作者使用cBioPortal分析了來自The Metastatic Breast Cancer Project(2020)的乳腺癌轉移發生率數據。重要的是,盡管INHBA基因表達水平在無轉移和有轉移的患者之間沒有顯著差異(圖6A),但患者的器官特異性分層顯示,原發腫瘤中INHBA的高表達與肺轉移顯著相關(圖6B),但與其他常見的乳腺癌轉移部位,包括肝臟、骨骼、腦/中樞神經系統或區域淋巴結無關(圖6C)。表明ActA在促進人類患者轉移中也具有肺特異性作用。此外,對TGFβ信號通路其他主要組分在位點特異性轉移患者數據集中的表達分析顯示,只有INHBA基因表達的增加與肺轉移的發生率相關,而該通路的其他組分保持不變(圖6D)。該分析進一步表明INHBA表達在肺轉移中的核心作用。值得注意的是,肺轉移患者中Follistatin (FST)基因也上調。FST是INHBA的拮抗劑配體,作為一種天然的反饋調節途徑,已知FST會響應ActA上調而上調。為了進一步研究INHBA表達水平對轉移和生存的重要性,作者分析了激素受體陰性和三陰性乳腺癌患者的數據集,并比較了原發乳腺腫瘤中INHBA高表達和低表達患者的無轉移生存時間。有趣的是,INHBA的高表達與無轉移生存期的顯著降低相關(圖6E),這表明ActA的上調有助于更快的進展。對包含多種乳腺癌亞型的乳腺癌患者的額外數據集的總生存率分析證實,原發腫瘤中INHBA高表達的患者的總生存率明顯低于INHBA低表達的患者(圖6F)。但高INHBA水平的患者轉移復發的時間顯著縮短(圖6G)。事實上,單因素Cox回歸分析表明,INHBA高表達可以預測無轉移生存(HR: 2.385;CI: 1.240-4.588)和總生存期(HR: 1.399;CI: 1.1017-1.925),進一步證實ActA信號在乳腺癌轉移進展中起重要作用(圖6H)。引人注目的是,使用各種臨床參數對無轉移生存進行的多變量分析顯示,高INHBA表達是該數據集中乳腺癌患者無轉移生存的only獨立預測因子(圖6I)。
綜上所述,作者的研究結果表明,ActA從原發性乳腺腫瘤中分泌,并在轉移前肺中系統性地誘導成纖維細胞活化,導致促纖維化基因的表達升高和膠原沉積增強。這有助于形成一個適宜的肺轉移生態位,導致轉移負擔增加和預后不良,在轉移器官中預防腫瘤誘導的纖維化可能是抑制或預防乳腺癌患者轉移復發的有效治療方法,并暗示ActA是抗轉移治療的潛在靶點。
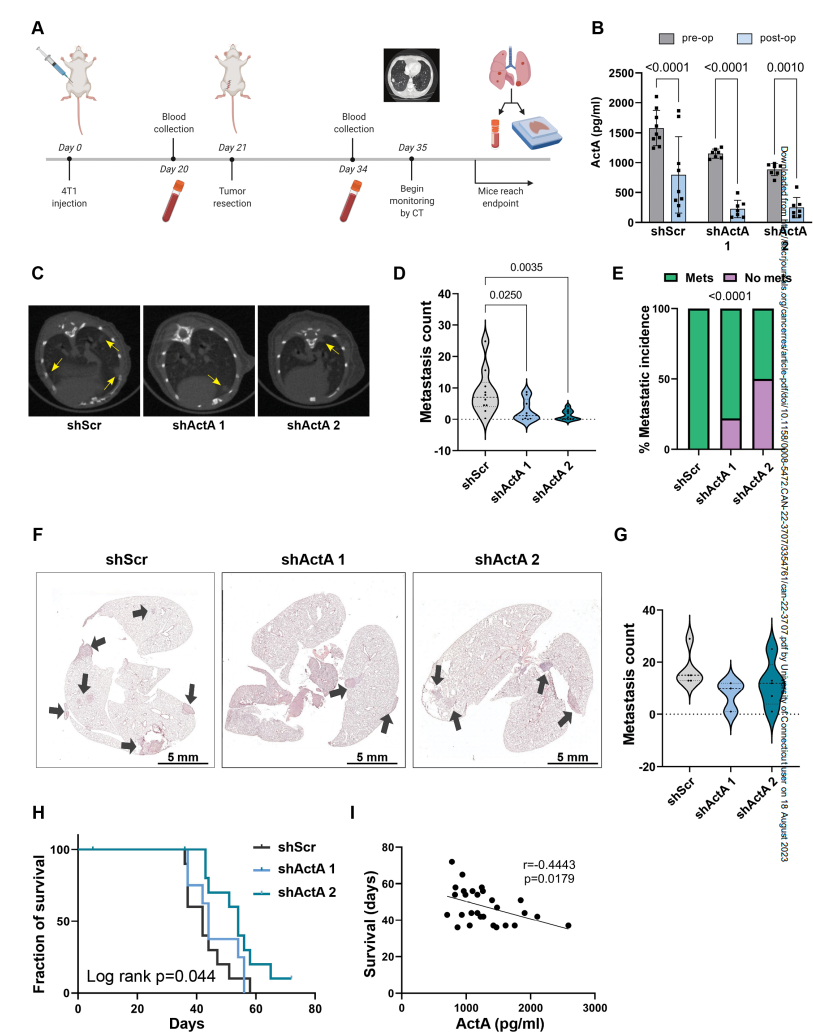
圖5 ActA KD抑制肺轉移,提高生存率
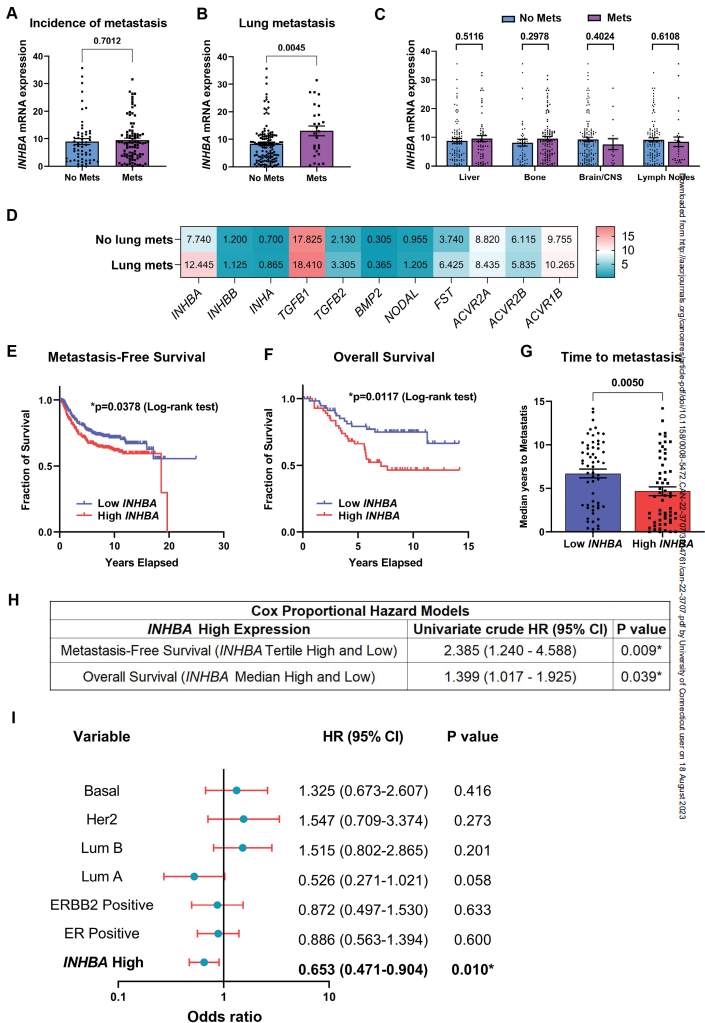
圖6 在乳腺癌患者中,ActA表達增加與肺轉移增加和生存率降低相關
實驗方法
構建細胞和動物模型,成纖維細胞分離,原位注射實驗,用CM和重組激活素A (rActA)檢測成纖維細胞,血漿蛋白質組學分析,酶聯免疫吸附試驗(ELISA),Western blot,流式細胞儀分析,實時定量PCR。
參考文獻
Cohen N, Mundhe D, Deasy SK, Adler O, Ershaid N, Shami T, Levi-Galibov O, Wassermann R, Scherz-Shouval R, Erez N. Breast Cancer-Secreted Factors Promote Lung Metastasis by Signaling Systemically to Induce a Fibrotic Premetastatic Niche. Cancer Res. 2023 Oct 13; 83(20): 3354-3367. Doi: 10.1158/0008-5472.CAN-22-3707. PMID: 37548552.






