胃癌中索拉菲尼誘導鐵死亡實錘——ATF2
索拉非尼是一種酪氨酸激酶抑制劑,在包括胃癌(GC)在內的多種癌癥中作為鐵死亡誘導劑具有重要的抗腫瘤作用。然而,索拉非尼作為鐵死亡誘導劑的作用最近受到了質疑。有關鐵死亡與ATF2關系的信息非常有限,而ATF2在索拉非尼誘導的鐵死亡中的作用也尚未研究。因而,本研究探討了GC中ATF2在索拉非尼誘導的鐵死亡中的作用及其分子機制。作者發現索拉非尼激活ATF2的表達,并進一步促進HSPH1的表達,減少SLC7A11蛋白的降解,從而導致對脂質過氧化的保護。在小鼠中,敲除ATF2能有效提高索拉非尼的敏感性。本文于2023年2月發表在《Redox Biology》IF: 11.4期刊上。
技術路線

主要實驗結果
1、ATF2在胃癌中表達上調,預示預后不良
TCGA數據顯示ATF2在胃癌組織中的高表達(圖1A),ATF2在GC細胞系中的表達也顯著高于非惡性細胞系(圖1B),在12對臨床樣本中,ATF2在胃癌組織中的表達也顯著高于癌旁(圖1C)。在107例GC組織和22例癌旁組織的GC芯片中檢測了ATF2的表達(圖1D),61.7%的GC組織高表達ATF2(圖1E),并且ATF2高表達的GC患者生存期更短(圖1F)。以上表明ATF2在胃癌中表達上調,預示預后不良。

圖1 ATF2在胃癌中表達上調,預示預后不良
2、ATF2敲除抑制GC細胞惡性表型
如圖2所示,過表達ATF2促進細胞增殖、遷移和侵襲,敲低ATF2則結果相反。表明ATF2促進GC惡性表型。
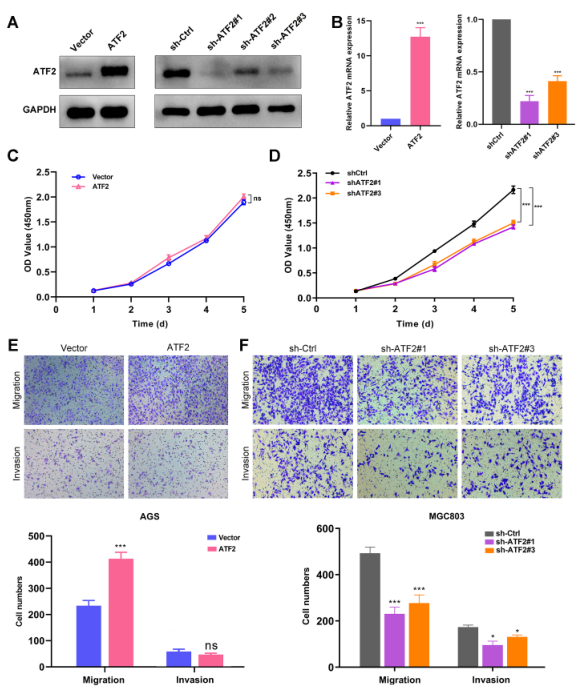
圖2 ATF2敲除抑制GC細胞惡性表型
3、索拉非尼誘導GC細胞鐵死亡并激活ATF2表達
由于先前的研究表明索拉非尼誘導的鐵死亡中存在不確定性,所以作者首先研究了索拉非尼是否會誘導GC細胞的鐵死亡。如圖3A所示,10 μM索拉非尼作用24 h后,AGS和MGC803細胞形態均縮小、變圓、排列疏松,而與鐵死亡抑制劑共同處理可以部分逆轉這些變化。與對照組相比,索拉非尼治療導致總細胞ROS和脂質ROS增加(圖3B-3C)。此外,用索拉非尼孵育導致MDA急劇增加而GSH下降,而這種影響被fer-1有效抑制(圖3D和E)。以上結果表明索拉非尼誘導GC細胞鐵死亡。

圖3索拉非尼誘導AGS和MGC-803細胞鐵死亡
鑒于鐵死亡與線粒體功能密切相關,接下來檢測線粒體膜電位(MMP)和形態學的變化。JC-1染色結果顯示,與對照組相比,索拉非尼治療顯著降低MMP(圖4A),透射電鏡顯示,索拉非尼處理的MGC803細胞線粒體嵴明顯減少或缺失,線粒體膜密度增加(圖4B)。這些結果也表明索拉非尼可以誘導GC細胞的鐵死亡。作為一種關鍵的應激反應轉錄因子,ATF2在索拉非尼誘導的鐵死亡反應中的表達變化仍然未知。如圖4C所示,索拉非尼處理增加ATF2的表達,尤其是磷酸化形式。值得注意的是,免疫熒光顯示,索拉非尼刺激后 ATF2 在細胞核中的表達量更高(圖4D)。因此,索拉非尼誘導的鐵變態反應可能會促進 ATF2 的核轉位并增強 ATF2 在 GC 細胞中的轉錄活性。
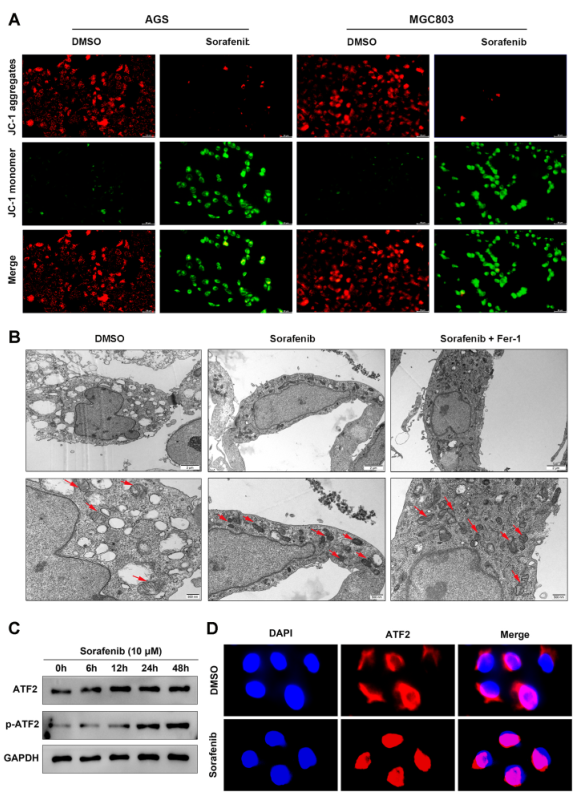
圖4索拉非尼治療增加GC細胞中ATF2的表達并促進其核易位
4、ATF2敲除抑制索拉非尼誘導的GC細胞鐵死亡
如圖5所示,為了解ATF2在索拉非尼誘導的鐵死亡中的作用,作者干預ATF2的表達水平并評估它們對鐵死亡的影響。與載體組相比,ATF2過表達導致AGS細胞中索拉非尼的IC50值升高,而ATF2敲低導致MGC803細胞中索拉非尼的IC50值降低(圖5A)。索拉非尼治療和ATF2敲低均升高了細胞總ROS和脂質ROS,ATF2敲低導致AGS細胞中ROS的進一步升高,而ATF2過表達抑制了索拉非尼在MGC803細胞中誘導的升高(圖5B-C)。在索拉非尼處理的GC細胞中,ATF2過表達導致MDA降低,GSH升高,而ATF2敲低則顯示相反的結果(圖5D-E)。TEM結果顯示索拉非尼治療后,ATF2敲低的GC細胞線粒體減少,膜密度增加,嵴退化,這種作用部分被ATF2過表達逆轉(圖5F)。這些發現表明ATF2過表達抑制索拉非尼誘導的GC細胞鐵死亡。
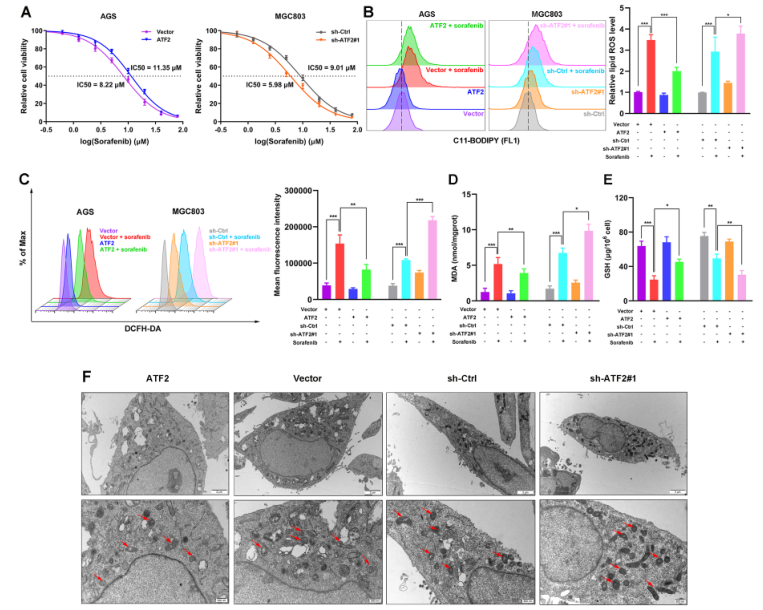
圖5 ATF2敲除抑制索拉非尼誘導的GC細胞鐵死亡
5、ATF2在GC細胞中激活HSPH1的轉錄
為進一步闡明其潛在機制,進行RNA-seq和ChIP-seq分析,以確定全基因組的DNA結合位點和ATF2的潛在轉錄靶點。如圖6A所示,RNA-seq分析顯示,與對照組相比,MGC803細胞中ATF2基因敲除后,有1059個基因上調,370個基因下調。重要的是,RNA-seq數據的通路富集分析表明,ATF2基因敲除會顯著影響鐵死亡通路(圖6B)。接下來,ChIP-seq共鑒定出24119個峰,對應3641個RefSeq基因,其中2.88%位于啟動子-轉錄起始位點(圖6C)。在染色體上觀察到了不同的峰值,并掃描了峰值之間共享的motif(圖6D和E)。
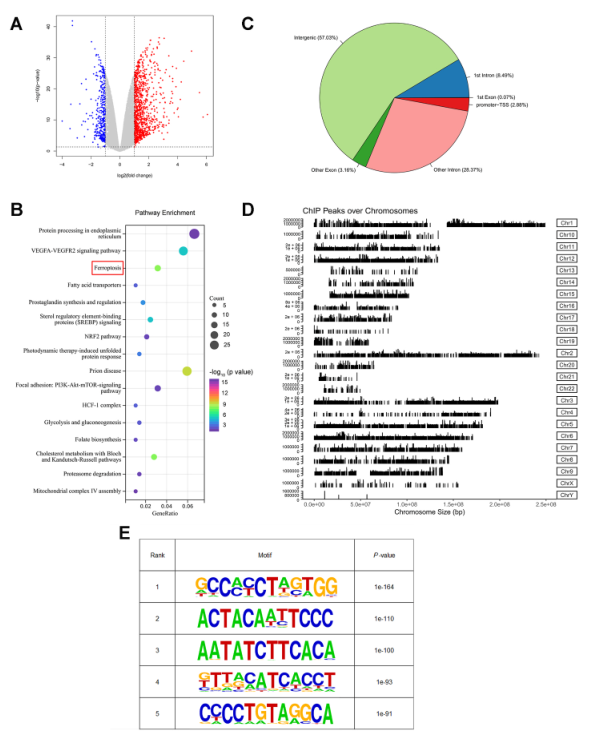
圖6利用RNA-seq和ChIP-seq技術鑒定ATF2的全基因組DNA結合位點和轉錄靶點
然后,對RNA-seq和ChIP-seq數據進行交叉分析,篩選出222個ATF2直接調控的候選轉錄靶點(圖7A)。其中,HSPH1在ATF2敲低后顯著下調(圖7B)。此外,在TCGA數據集中,HSPH1在GC中的表達與ATF2呈顯著正相關(圖7C)。如圖7D所示,ChIP-seq數據顯示HSPH1啟動子區域存在顯著的ATF2結合峰。因此,作者推測HSPH1可能是ATF2的潛在靶基因。WB分析結果顯示,ATF2過表達后,HSPH1增加,而ATF2敲除后,HSPH1減少(圖7E)。此外,ChIP-qPCR進一步證實ATF2可與HSPH1的啟動子區域結合(圖7F)。這些數據表明ATF2可以通過與HSPH1啟動子結合來激活HSPH1的表達。
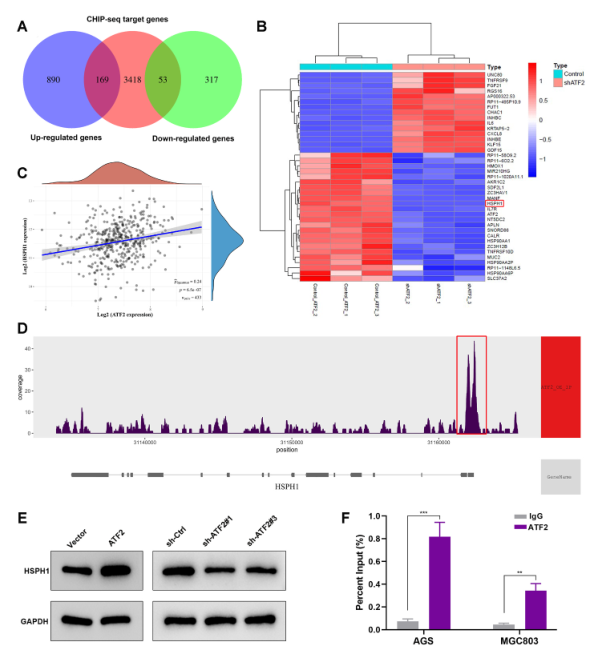
圖7 ATF2結合HSPH1啟動子激活其轉錄
6、HSPH1與SLC7A11在GC中相互作用并增加其穩定性
鑒于多項研究報道了熱休克蛋白在鐵死亡反應中的突出作用,作者試圖確定 HSPH1是否會影響SLC7A11在GC中的表達。首先查詢GeneMANIA數據庫,預測并顯示HSPH1與SLC7A11之間潛在的相互作用(圖8A)。為驗證這一預測,進行co-IP實驗,確定HSPH1與SLC7A11存在物理相互作用(圖8B)。采用siRNA敲除HSPH1的表達(圖8C),并將HSPH1 siRNA轉染到ATF2穩定過表達的AGS細胞中。有趣的是,觀察到HSPH1的敲除降低了SLC7A11的蛋白表達水平,但沒有降低mRNA水平(圖8D)。因此,進行CHX追逐試驗,以確定在是否敲除HSPH1的情況下SLC7A11蛋白的半衰期。WB分析表明,與對照組相比,抑制HSPH1會加速AGS細胞中SLC7A11蛋白的降解(圖8E)。這些結果表明,HSPH1可以與SLC7A11相互作用,并至少部分地通過增加SLC7A11蛋白的穩定性來增加其表達。敲除HSPH1可部分消除ATF2過表達對細胞ROS和脂質ROS的影響(圖8F和G)。同樣,聯合轉染HSPH1 siRNA能顯著逆轉ATF2過表達對鐵變態細胞死亡中細胞MDA和GSH水平的影響(圖8H和I)。這些結果為ATF2通過HSPH1調控索拉非尼誘導的GC細胞鐵死亡提供了證據。
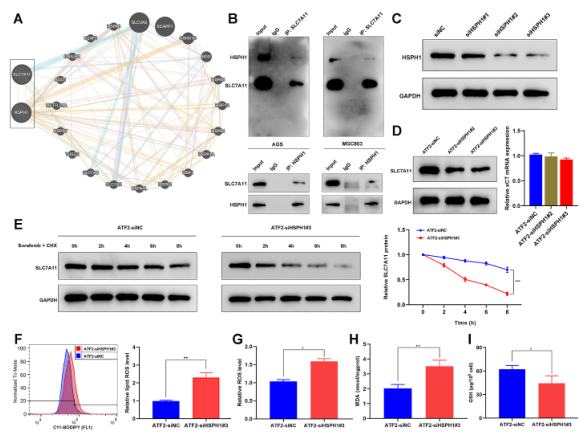
圖8 HSPH1與SLC7A11相互作用,提高其在GC中的穩定性
7、體內ATF2敲低增加GC對索拉非尼的敏感性
最后,為評估ATF2單獨和聯合索拉非尼對體內GC的影響,建立裸鼠異種移植模型(圖9A)。穩定ATF2敲除細胞形成的腫瘤始終比對照GC細胞形成的腫瘤更小更輕,這表明ATF2敲除能有效抑制體內腫瘤的生長(圖9B)。此外,經索拉非尼治療后,皮下腫瘤的體積和重量均顯著減少(圖9C和D)。也就是說,ATF2敲除聯合索拉非尼治療對腫瘤生長的抑制作用最強。為更好地觀察潛在的死亡,皮下腫瘤切片被4-HNE染色,IHC染色顯示,sh-ATF2 +索拉非尼組的4-HNE 表達量最高(圖9E)。因此,ATF2基因敲除可增強索拉非尼在體內對GC的抗腫瘤作用。
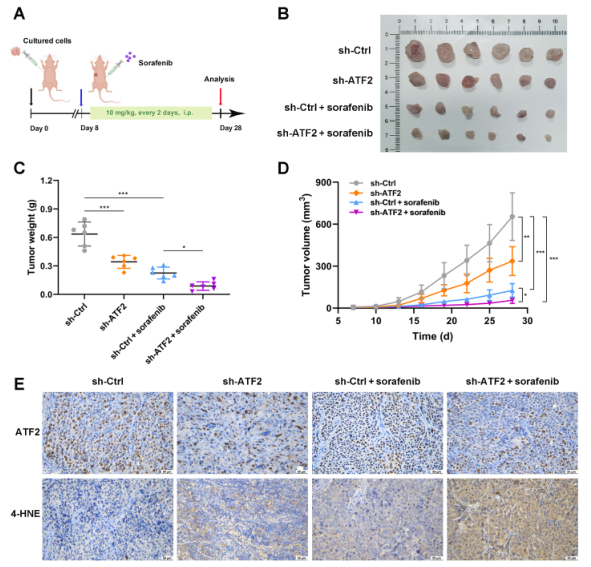
圖9體內ATF2敲低增加GC對索拉非尼的敏感性
總之,在本研究中,作者發現索拉非尼激活ATF2的表達,并進一步促進HSPH1的表達,減少SLC7A11蛋白的降解,從而導致對脂質過氧化的保護(圖10)。因此,以ATF2/HSPH1軸為靶點來增強索拉非尼誘導的鐵死亡代表了一種有吸引力的GC治療策略。

圖10 圖像摘要
實驗方法
胃癌臨床樣本采集,細胞培養和轉染,WB,RT?PCR,IHC,細胞生長曲線,IC50檢測,Transwell遷移和侵襲,Calcein-AM/PI染色,ROS和脂質過氧化檢測,MDA和GSH檢測,線粒體膜電位檢測,透射電鏡TEM,RNA-seq,ChIP-seq,共免疫沉淀(Co-IP),蛋白穩定性CHX實驗,小鼠模型,
參考文獻
Xu X, Li Y, Wu Y, Wang M, Lu Y, Fang Z, Wang H, Li Y. Increased ATF2 expression predicts poor prognosis and inhibits sorafenib-induced ferroptosis in gastric cancer. Redox Biol. 2023 Feb;59:102564. doi: 10.1016/j.redox.2022.102564. Epub 2022 Dec 2. PMID: 36473315; PMCID: PMC9723522.






