治療帕金森病——響應性人工酶原位持續供給多巴
口服二羥苯丙氨酸(多巴)補充神經元多巴胺仍然是帕金森病(PD)最有效的治療方法。然而,與正常神經元持續穩定的多巴胺信號不同,口服多巴引起血漿多巴水平劇烈波動,導致多巴誘導的運動障礙。在此,作者報道了一種基于功能核酸的響應性人工酶(FNA-Fe3O4)用于原位連續生產Dopa。FNA-Fe3O4可以跨越血腦屏障,依靠轉鐵蛋白受體適配體靶向病變神經元。然后,FNA-Fe3O4響應病變神經元中過表達的α -突觸核蛋白mRNA進行反義寡核苷酸處理和熒光成像,同時轉換為模擬酪氨酸羥化酶的酪氨酸適配體人工酶(Apt-Fe3O4)用于原位連續生產多巴。體內FNA-Fe3O4治療導致PD小鼠模型中Dopa和多巴胺水平恢復,病理性過表達的α -突觸核蛋白減少,從而改善運動癥狀和記憶缺陷。本文提出的基于功能核酸的響應性人工酶策略為PD的診斷和治療提供了一種更神經元友好的方法。本研究于2023年5月發表于期刊《Nature Communications》上,IF:16.6。
技術路線:
主要研究結果:
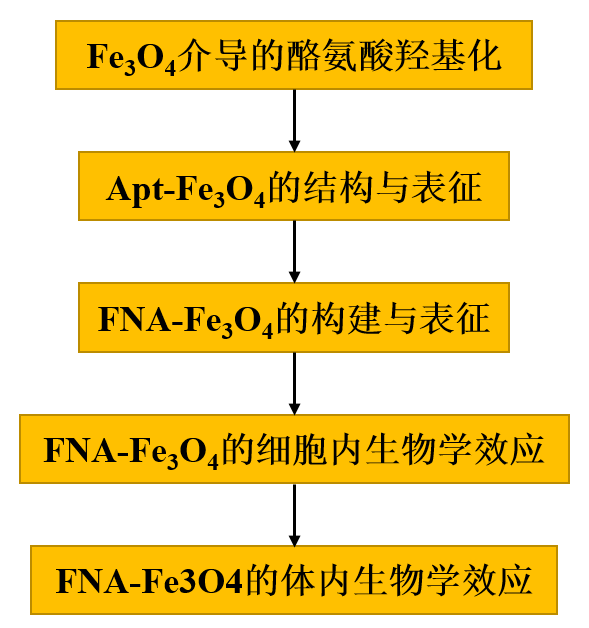
在本研究中,作者首先詳細解釋了Fe3O4納米粒子在過氧化氫(H2O2)和抗壞血酸(AA)存在的情況下,對酪氨酸羥基化產生多巴(圖1a,Phase I)。進一步構建了基于酪氨酸適配體的人工酶(Apt-Fe3O4),其中Fe3O4作為催化活性中心,酪氨酸適配體29作為底物結合位點(圖1a,Phase II)。在病變神經元中,FNA-Fe3O4被轉化為Apt-Fe3O4以響應高水平的SNCA mRNA,從而表現出類似于Dopa產生的酪氨酸羥化酶活性(圖1a,Phase III)。

圖1
1、Fe3O4介導的酪氨酸羥基化
Fe3O4納米顆粒先前被報道可以催化酪氨酸的多步氧化,通過中間產物多巴(Dopa)生成最終產物多巴色素。然而,中間產品Dopa形成的詳細機制尚未得到解釋。因此,作者探究中間產物Dopa的穩定存在,以及在病理濃度的AA和H2O2存在下Fe3O4催化酪氨酸羥基化生成Dopa的過程。以市售15 nm水分散表面羧基修飾的Fe3O4納米粒子為模型,考察其催化酪氨酸羥基化合成多巴的性能。圖2a顯示了在10 μg mL-1 Fe3O4、5 mM H2O2和5 mM AA存在下,100 μM酪氨酸羥化轉變成多巴過程中的含量變化。反應混合物中的每個組分都是驅動酪氨酸羥基化為多巴所必需的(圖2b)。根據這些組分的反應活性,可能存在多種活性自由基中間體。tert-Butanol傾向于主要淬滅·OH,而乙醇能有效清除·OH和Fe(IV)=O39。反應體系中tert-Butanol的加入在5 min后輕度抑制了反應39.4 %,而乙醇的加入誘導了更嚴重的抑制60.4 %(圖2c)。這些差異可歸因于羥基化過程中·OH和高自旋Fe(IV)=O的參與。
為進一步了解Fe3O4在H2O2和AA存在下催化酪氨酸羥基化生成Dopa的機理,作者進行了一系列電子自旋共振(ESR)實驗,并將這些結果與反應的活性中間體進行了關聯。圖2d顯示了Fe3O4與H2O2共存的混合體系中明顯的羥基自由基(·OH)信號,這與Fe3O4納米酶40固有的過氧化物酶活性一致。圖2e表明,Fe3O4與AA共存時,沒有檢測到自由基的產生。而在Fe3O4、H2O2和AA存在下,觀察到新的自由基信號為過氧自由基(·OOH),并且伴隨著體系中·OH的完全消失(圖2f)。H2O2與AA之間沒有發生直接的自由基反應(圖2g)。這些結果表明AA是·OOH形成的關鍵促進劑并導致·OH耗竭。進一步地,在·OOH的混合體系中加入酪氨酸底物后,·OOH的強度降低,自由基種類沒有發生變化(圖2h),暗示·OOH為酪氨酸向多巴的轉化提供了關鍵物種。據報道,·OOH與Fe2+結合生成高自旋Fe(IV)= O中間體41,其結構與生物蛋白酪氨酸羥化酶的活性中心相似。以二甲基亞砜(DMSO)作為Fe(IV)=O的探針,通過氧原子轉移與Fe(IV)= O反應生成二甲基砜(MSM)。根據圖2i的氣相色譜-質譜(GC-MS)分析結果,隨著反應時間的延長,MSM的峰逐漸增強,表明可能發生了Fe(IV)= O。這些結果為酪氨酸羥基化的機理路徑提供了有效的解釋(圖2j)。Fe3O4與H2O2反應產生的·OH在AA的催化作用下轉化為·OOH。然后·OOH介導生成活性中間體Fe(IV)=O,最后羥基化酪氨酸生成多巴。

圖2 Fe3O4納米顆粒的酪氨酸羥化酶模擬活性
2、Apt-Fe3O4的結構與表征
適體結合位點與納米酶的共價連接被引入作為一種通用的方法,通過將反應底物集中在催化納米酶核心上來提高納米酶的催化活性,從而模擬天然酶的結合和催化活性位點功能(圖3a)。在確定Fe3O4納米酶的酪氨酸羥化酶模擬活性后,通過EDC/NHS介導的酰胺縮合反應將Fe3O4納米酶與5 '端氨基修飾的酪氨酸適體共價偶聯,構建基于酪氨酸適體的人工酶Apt-Fe3O4。作者還制備了隨機序列DNA偶聯的Fe3O4(Ran-Fe3O4)用于對比。
作者考察不同濃度的酪氨酸(所有實驗均使用5 mM H2O2和5 mM AA)在Fe3O4、Ran-Fe3O4和Apt-Fe3O4(10 μg mL-1)的催化作用下,酪氨酸羥化生成多巴的速率隨酪氨酸濃度的變化,如圖3b的動力學曲線所示。對于Apt-Fe3O4或對照,觀察到Michaelis-Menten-type saturation kinetic曲線。與純Fe3O4相比,Ran-Fe3O4的催化活性幾乎相同,而Apt-Fe3O4的催化活性顯著提高。Apt-Fe3O4催化活性的增強歸因于靠近催化界面的底物的高局部濃度,這是由于適配體與酪氨酸底物的特異性結合。
值得注意的是,水溶液作為最簡單的模型,無法模擬實際的細胞內大分子擁擠環境。因此,在以20 wt % PEG-20000作為擁擠劑的模擬擁擠環境中評估了Apt-Fe3O4和對照的催化能力。如圖3c所示,與水溶液中的催化速率相比,Fe3O4和Ran-Fe3O4的催化速率明顯下降,表明它們的催化功能在復雜的細胞環境中受到嚴重干擾。然而,Apt-Fe3O4令人滿意地保留了其大部分催化效率,這無疑是適配體對酪氨酸的選擇性捕獲。酪氨酸與適配體的特異性結合,增加了酪氨酸在Apt-Fe3O4上的停留時間,有利于活性中間體的形成,使反應易于在擁擠的環境中進行。這一特性有利于基于酪氨酸適配體的人工酶Apt-Fe3O4在復雜的細胞內環境中執行催化任務。
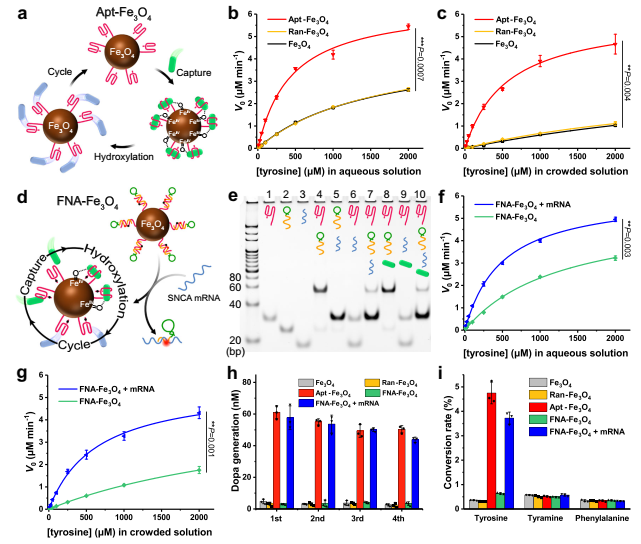
圖3 人工酶的表征及其催化和熒光成像性能
3、FNA-Fe3O4的構建與表征
其次,為實現人工酶對PD治療的高效BBB穿越和神經元特異性響應,設計了由SNCA反義寡核苷酸和TfR適配體組成的阻斷鏈,并與Apt-Fe3O4上的酪氨酸適配體雜交,構建了基于功能核酸的響應型人工酶FNA-Fe3O4(圖3D)。
通過聚丙烯酰胺凝膠電泳(PAGE)驗證FNA-Fe3O4響應SNCA mRNA的鏈置換反應性。如圖3e所示,嵌段鏈可以首先與酪氨酸適配體雜交(泳道4)。該雙鏈在酪氨酸的生理濃度范圍內穩定(泳道8)。然而,嵌段鏈隨后被SNCA mRNA取代以釋放游離的酪氨酸適體(泳道10)。同時,監測SNCA相關生物標志物的含量可以為PD的熒光成像提供有效手段。
隨后測定了FNA-Fe3O4在SNCA mRNA存在和不存在時的酪氨酸羥化酶模擬活性。如圖3f中的動力學曲線所示,在水溶液和擁擠溶液中,FNA-Fe3O4與SNCA mRNA發生鏈置換反應后表現出較高的催化活性。而單獨的FNA-Fe3O4的催化活性保持在較低的水平,尤其是在擁擠溶液中。這一特性提供FNA-Fe3O4不會影響正常細胞中多巴胺穩態的潛力,僅在SNCA mRNA異常過表達的細胞中提供Dopa。
FNA-Fe3O4與SNCA mRNA反應后,能夠連續捕獲酪氨酸溶液中的酪氨酸,并在含有H2O2和AA的溶液中催化酪氨酸羥基化,反應5 min內的多巴生成在4次重復中保持穩定(圖3h),這將是人工酶典型的循環催化過程的有力證明。此外,以幾種常見的能夠芳香環羥基化的胞內小分子(酪胺和苯丙氨酸)作為模型干擾物,測試人工酶對酪氨酸的底物選擇性。如圖3i所示,在反應5 min內,FNA-Fe3O4 + mRNA對酪氨酸的羥基化轉化率遠高于其他干擾物質,對酪氨酸表現出優異的選擇性,證明了其胞內抗干擾能力。此外,在含有酪氨酸、H2O2和AA的Apt-Fe3O4、FNA-Fe3O4和FNA-Fe3O4 + mRNA(10 μg mL-1)溶液中,反應30 min后均未產生DNA片段,說明了反應過程中DNA鏈的穩定性。
4、FNA-Fe3O4的細胞內生物學效應
BBB是FNA-Fe3O4進入多巴胺能神經元的第一個障礙。因此,用表達TfR的永生化小鼠腦內皮細胞(bEnd.3)建立體外BBB模型,在頂端側加入人工酶,考察其穿膜效率(圖4a)。隨著時間的推移,FNA-Fe3O4在基底側逐漸累積,120 min后轉運效率上升至21.8 %(圖4b)。相比之下,Apt-Fe3O4,Ran-Fe3O4,和不含TfR適配體的Fe3O4在基底側緩慢積累。這些結果表明FNA-Fe3O4可以高效地通過體外BBB模型,其中TfR適配體發揮了重要作用。
在驗證了FNA-Fe3O4的跨BBB作用后,作者進一步檢測其在神經元中的內化情況。作者使用TfR陽性的小鼠小膠質細胞BV2細胞作為PD的細胞模型。以Cy5修飾的不含BHQ2的FNA-Fe3O4為熒光探針,以Apt-Fe3O4和Ran-Fe3O4為熒光探針。與不含TfR適配體的Apt-Fe3O4和Ran-Fe3O4相比,FNA-Fe3O4對目標BV2細胞具有更好的結合位移(圖4c)。代表FNA-Fe3O4的強烈Cy5熒光信號主要定位于BV2細胞的細胞質中,并在較長時間內保持在胞內高水平(圖4d)。細胞活性測試結果表明FNA-Fe3O4對BV2細胞幾乎沒有明顯的細胞毒性(圖4e),表明其與腦內皮細胞具有良好的生物相容性。這些性質為FNA-Fe3O4的細胞內應用提供基礎。
為評估核酸組分在FNA-Fe3O4上的功能,作者設計了兩種對照納米材料。Cat-Fe3O4代表酪氨酸羥化酶模擬活性的影響,ASO-Fe3O4代表反義寡核苷酸療法(圖5a-b)。作者通過其脫羧產物多巴胺的含量來監測。如圖5c所示,FNA-Fe3O4處理的正常細胞內多巴胺含量變化不大,表明其不會干擾正常神經元內多巴胺穩態。在FNA-Fe3O4處理的PD細胞中,多巴胺含量在8 h內呈逐漸上升趨勢,隨后達到穩定平臺期。這一結果證明,FNA-Fe3O4可以在細胞中發揮類似酪氨酸羥化酶的功能,以應對細胞特異性空間控制的SNCA mRNA的異常過度表達。同時,Cat-Fe3O4也表現出類似的酪氨酸羥化酶模擬活性,而ASO-Fe3O4則沒有,這反映了酪氨酸適配體對人工酶催化的決定性作用。作者還嘗試了直接多巴孵育(0.5、2、8 μM)對細胞內多巴胺水平的影響。孵育2 h后更換培養液模擬多巴胺短的血漿半衰期,細胞內多巴胺含量逐漸降低(圖5d)。較高劑量的多巴維持了較長時間的多巴胺水平,但也導致了多巴胺含量更劇烈的波動。總的來說,多巴胺水平的長期增加意味著多巴治療的時間更長,而多巴胺水平的劇烈波動預示著神經元中多巴胺的穩態失調。這是導致多巴的治療效果和副作用控制無法平衡的根本原因。相比之下,FNA-Fe3O4提供的原位連續多巴產量表現出更長的持續時間和更可接受的多巴胺波動。需要指出的是,由于多巴和多巴胺的有效生理濃度遠低于酪氨酸,因此應用FNA-Fe3O4進行酪氨酸羥基化不會影響細胞內酪氨酸穩態。
將阻斷鏈與SNCA mRNA雜交也降低了SNCA的表達。人工酶共孵育36 h后,FNAFe3O4和ASO-Fe3O4降低PD細胞模型SNCA蛋白表達水平(圖5e),有利于延緩神經元退變。同在圖5f的熒光分析中,顯示EGFP綠色熒光信號的細胞為SNCA mRNA過表達細胞。FNA-Fe3O4對共培養的正常細胞和PD細胞顯示出不同的熒光信號強度,證明FNA-Fe3O4可以響應過表達的SNCA mRNA通過熒光成像區分正常和PD神經元(圖5g)。相應的流式細胞儀獲得了一致的熒光分析結果(圖5h)。這些結果表明FNA-Fe3O4能夠監測細胞內SNCA mRNA的表達水平。

圖4 人工酶的細胞可利用性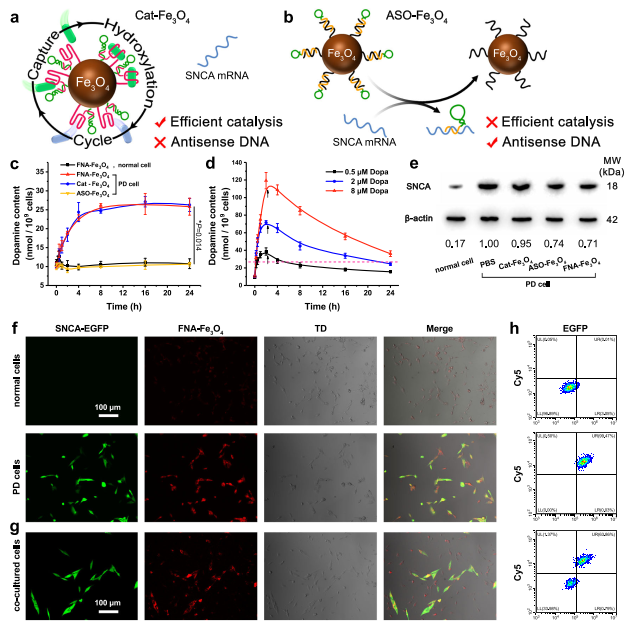
圖5 人工酶的細胞內生物學效應
5、FNA-Fe3O4的體內生物學效應
研究分別以野生型小鼠和攜帶小鼠胸腺細胞抗原1(Thy1)啟動子驅動的人野生型SNCA的Thy1-SNCA轉基因小鼠作為正常和PD動物模型。與正常小鼠相比,尾靜脈注射FNA-Fe3O4后4 h內,PD小鼠腦內可觀察到逐漸增強的Cy5熒光信號(圖6a),表明FNA-Fe3O4可實現PD動物模型的成像。
隨后,在PD小鼠尾靜脈注射Cat-Fe3O4、ASO-Fe3O4或FNA-Fe3O4(4 mg kg-1)時進行紋狀體微透析,分析人工酶催化原位Dopa產生。具有類酪氨酸羥化酶特性的Cat-Fe3O4和FNA-Fe3O4使腦組織中多巴和多巴胺水平升高至略低于正常水平,而ASO-Fe3O4未引起多巴和多巴胺水平的變化(圖6b-c)。這一趨勢表明人工酶介導了腦內多巴胺系列神經遞質生成的恢復。相應地,比較了Dopa給藥期間的微透析結果。多巴胺的上升趨勢只維持了(約4 h內)短暫的時間且波動較大(圖6d),從而顯示出人工酶策略的優越性。經過20天的治療后(圖6e),反義寡核苷酸ASO-Fe3O4和FNA-Fe3O4顯著降低了腦組織中SNCA的表達,而Cat-Fe3O4對過表達SNCA的影響可以忽略(圖6f)。這一結果揭示人工酶上反義寡核苷酸部分對于調控過表達SNCA的重要性。
持續的原位多巴生成和緩解異常的SNCA過表達共同作用于Thy1-SNCA小鼠的PD病理特征。因此,進一步通過爬桿實驗和懸線實驗(圖6g-h)評價小鼠的運動協調能力。可見,PD小鼠的運動協調能力明顯差于健康小鼠。Cat-Fe3O4和ASO-Fe3O4部分恢復了PD小鼠的運動能力,分別反映了酪氨酸羥化酶替代治療和反義寡核苷酸治療對PD癥狀的緩解。單獨使用Cat-Fe3O4的治療效果略優于ASO-Fe3O4,因為原位多巴供給可以直接作用于多巴胺能神經系統。反義寡核苷酸治療的貢獻在于緩解PD病理過程,因此FNA-Fe3O4治療的小鼠表現出比單藥治療更好的性能。此外,PD小鼠可表現出學習記憶能力的下降,可通過被動回避實驗進行檢測。24 h滯留中更長的穿越潛伏期代表更完整的學習記憶。在PD小鼠中給予Cat-Fe3O4和ASO-Fe3O4在相似的水平上有助于改善學習和記憶的下降,并且FNA-Fe3O4治療更明顯。這些結果表明FNA-Fe3O4可以促進PD小鼠模型的運動障礙和記憶缺陷的恢復,其治療作用來源于酪氨酸羥化酶模擬活性和反義寡核苷酸的協同作用。
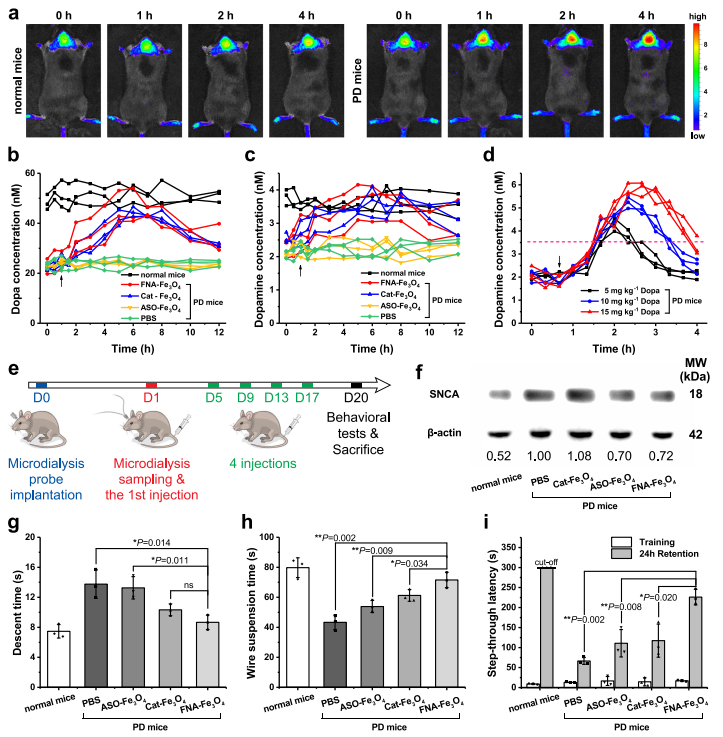
圖6 人工酶的體內生物學效應
實驗方法
SH-SY5Y和bEnd.3細胞培養,體外構建血腦屏障細胞模型,人工酶的細胞內化,CCK-8,細胞內多巴胺和酪氨酸含量的測定,qRT-PCR,免疫印跡,人工酶對細胞SNCA mRNA的熒光分析,C57BL/6 N(6個月)小鼠,Thy1-SNCA 轉基因小鼠,FNA-Fe3O4中塊鏈的質譜,離體成像,體內血液循環測定,免疫熒光,血清生化分析,溶血試驗
參考文獻
Fang X, Yuan M, Zhao F, Yu A, Lin Q, Li S, Li H, Wang X, Yu Y, Wang X, Lin Q, Lu C, Yang H. In situ continuous Dopa supply by responsive artificial enzyme for the treatment of Parkinson's disease. Nat Commun. 2023 May 9;14(1):2661. doi: 10.1038/s41467-023-38323-w. PMID: 37160866; PMCID: PMC10169781.






