踏上circRNA的潮流,探索骨肉瘤的新型治療措施
環狀RNA(circRNA)是一類特殊的非編碼RNA分子,在許多疾病中發揮著重要的調控作用。而難治性轉移性骨肉瘤(OS)標準治療的臨床療效不理想,新興的抗血管生成方案仍處于嬰兒期。本研究發現circFIRRE是OS腫瘤發生和血管生成的主要調控因子,并從體外和體內初步驗證YY1-circFIRRE-miR-486-3p / miR-1225-5p-LUZP1通路在OS中的調控作用。這些結果提示circFIRRE能夠作為一種新的預后生物標志物和難治性OS的治療靶點。本研究于2022年8月發表在《Molecular Cancer》IF:41.444的期刊上。
技術路線:

主要研究結果:
1. circFIRRE在OS樣品和細胞中的篩選和表征
作者通過rRNA-depleted RNA-seq分析四對OS組織和正常相鄰樣本的circRNA表達圖譜。表達異常的circRNA以火山圖的形式展現在圖1A中。作者選出前五個表達上調的circRNA,分別是circRUNX2(hsa_circ_0003563)、circSATB2(hsa_circ_0003915)、circFIRRE(hsa_circ_0001944)、circAFF2(hsa_circ_0001947)和circBBS9(hsa_circ_0003162)。然后開展對16對樣本中的這五種異常表達的circRNA進行RT-qPCR分析工作。結果發現circFIRRE因OS組織和鄰近的組織差異最大而差異表達最顯著(圖1B)。擴大樣本量至104對匹配的臨床OS樣本和鄰近正常樣本,RT-qPCR分析結果顯示,circFIRRE表達顯著上調(圖1C)。另外,FISH實驗使用五對新鮮的患者樣本也證實了上調趨勢(圖1D)。與成骨細胞系(hFOB1.19)相比,143B、SJSA-1、HOS、U2OS和MG63這五個細胞系的circRNA表達顯著上調,特別是U2OS和MG63(圖1E)。circFIRRE的亞細胞定位在細胞功能中是很重要的。作者經過核質分離后的RT-qPCR分析發現細胞質中circFIRRE表達在U2OS和MG63細胞中也顯著上調(圖1F-G),RNA FISH實驗表明circFIRRE約有80%在細胞質中,20%在細胞核中(圖1H)。circFIRRE的確切大小為1096 bp,其特異的反式剪接被Sanger測序證實(圖1I)。用放線菌素D處理MG63和U2OS細胞后檢測circFIRRE的穩定性,發現其可以在轉錄上抑制RNA合成,circFIRRE的半衰期大于24小時,比linearFIRRE在轉錄上更穩定,linear FIRRE的半衰期小于5 h(圖1J-K),circFIRRE能抵抗RNase R酶的消化,而FIRRE在處理后很容易降解(圖1L-O)。這些結果提示circFIRRE可以在OS細胞中持續穩定表達,也可能成為診斷或預后預測的生物標志物。
考慮到反剪接可能來自反式剪接或基因組重排,因而采用瓊脂糖凝膠電泳(AGE)排除基因組重排的可能性。circFIRRE和linearFIRRE分別用發散引物和收斂引物在OS細胞的cDNA和基因組DNA提取物中擴增。AGE檢測發現circFIRRE只存在于cDNA中,而不存在于基因組DNA中(圖1P-Q)。
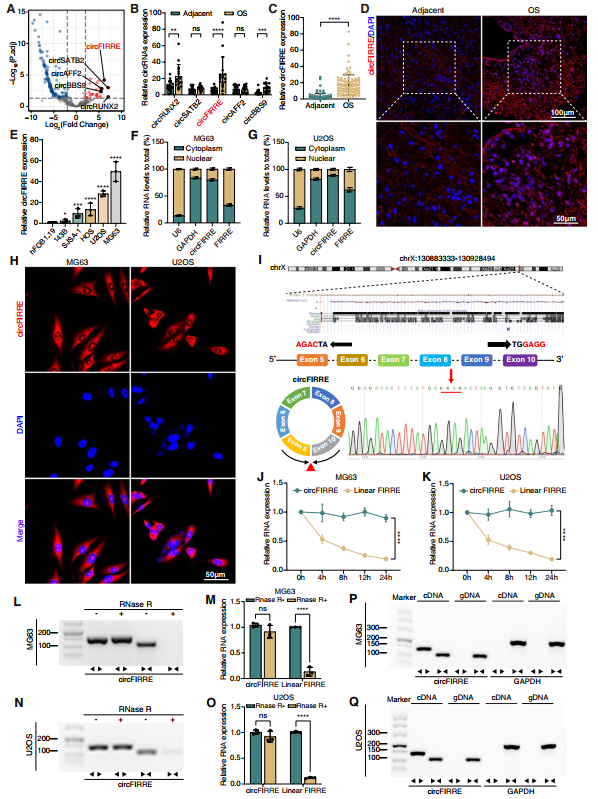
圖1 識別和驗證OS組織和細胞中下調的circFIRRE。
2. circRNA上調預示OS病人的腫瘤轉移風險更大和不良預后
為評估總生存期(OAS)和無病生存期(DFS)的危險因素,作者進行采單因素和多因素分析。單因素分析顯示,年齡、手術方式、腫瘤轉移和circFIRRE高表達與OAS和DFS相關。在這些變量中,多因素分析顯示年齡、手術方式、circFIRRE轉移和表達升高是OS患者預后的獨立危險因素(圖2A-D)。此外,Kaplan-Meier生存曲線顯示circFIRRE高表達組的OAS和DFS比circFIRRE低表達組更低(圖2E-F)。circFIRRE的高表達水平與較短的生存期、較差的臨床結果和較高的風險評分呈正相關(圖2G)。以上結果說明circFIRRE可作為OS患者的獨立危險因素,參與OS的進展和轉移。
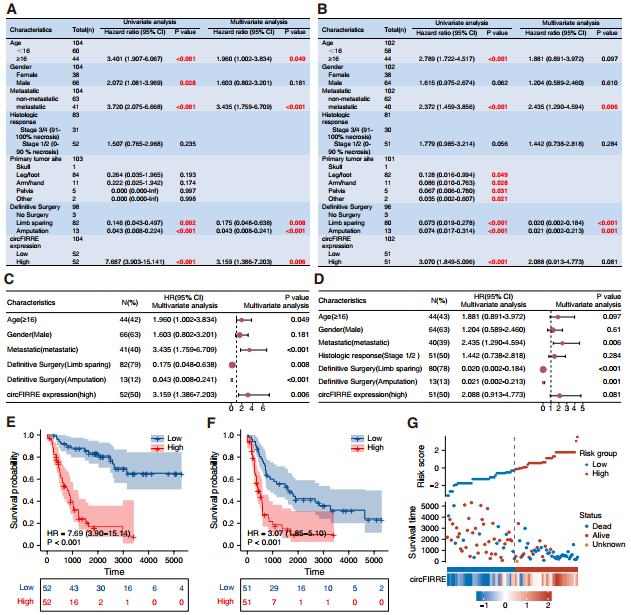
圖2 確定circFIRRE作為預測OS預后的獨立危險因素。
3. circFIRRE促進體外OS的進展
為調查OS的生物狀態的標志,作者們展開特征基因集的GSEA分析。在MG63和U2OS中建立circFIRRE穩定敲除細胞系(圖3A)。然后,作者們執行CCK8和EdU檢測OS細胞增殖能力。結果顯示,與陰性對照細胞相比,sh-circFIRRE細胞增殖及EdU結合顯著降低(圖3B-F)。Transwell遷移和侵襲實驗中,circFIRRE下調降低OS細胞遷移和侵襲的能力(圖3G-I)。流式細胞術評估細胞周期,發現sh-circFIRRE細胞被阻滯在G0/G1期,表明circFIRRE敲低可促進細胞周期阻滯。這些說明circFIRRE敲低體外抑制OS腫瘤生長和活性。RT-qPCR驗證過表達效率,并證實轉染不影響linearFIRRE表達(圖3J)。CCK8和EdU分析顯示circFIRRE過表達顯著促進MG63和U2OS增殖(圖3K-O)。這些說明circFIRRE參與體外OS的生長、遷移和侵襲。
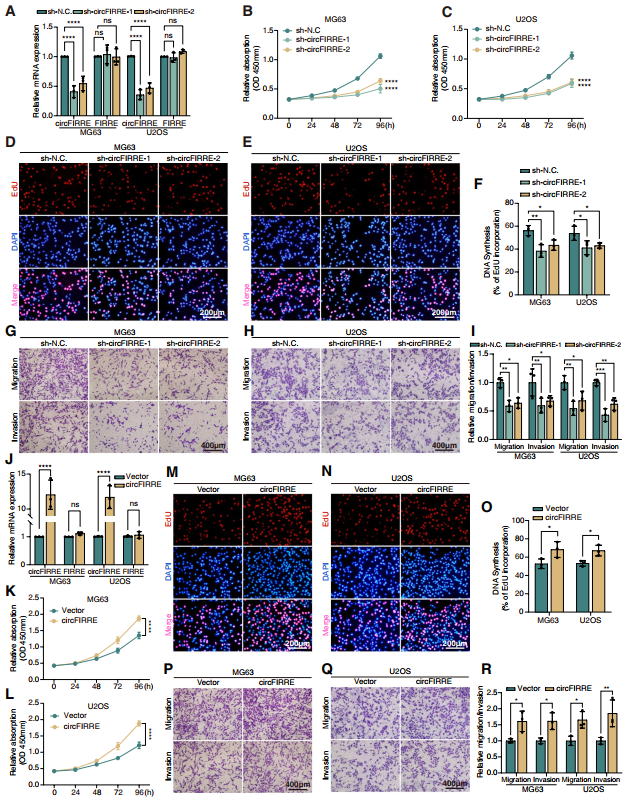
圖3 體外circFIRRE影響OS的生長、遷移和侵襲。
4. circFIRRE誘導血管生成
作者推測circFIRRE在OS肺轉移中可能參與血管生成。為驗證猜想,作者對轉移性OS組織內皮細胞中circFIRRE是否富集進行研究。作者們從局限性骨肉瘤患者和三個臨床轉移性骨肉瘤患者的樣本中獲得原發性內皮細胞,通過CD31+磁珠分選,檢測circFIRRE在內皮細胞中的差異表達(圖4A)。RT-qPCR分析顯示,相對于非轉移性OS中的內皮細胞,轉移性OS中的circFIRRE顯著上調(圖4B),揭示其在血管生成和OS轉移中的潛在作用。三種常見的內皮細胞系(HUVEC,EA.hy926,hmec1),HUVEC細胞circFIRRE表達水平最高。因此,作者選擇HUVEC進行血管生成研究。將三個circFIRRE靶向siRNAs轉入HUVEC細胞,發現si-1和si-2具有較好的敲低效果,降低50%以上的circFIRRE表達水平(圖4D)。si-1和si-2將用作后面的功能實驗。tube formation assay再次驗證,與對照組相比,si-circFIRRE顯著降低HUVEC細胞的增殖、遷移和管形成能力(圖4E-F)。主動脈環檢測顯示,si-circFIRRE轉染的主動脈環在膠原中包埋7天,微血管面積較正常組小(圖4G)。CAM是一種血管高度分化的雞胚外膜,si-circFIRRE共孵育后新形成的血管明顯受損(圖4H)。這些結果表明circFIRRE下調顯著抑制血管生成。對新芽進行tube formation assay,結果顯示circFIRRE過表達顯著增加HUVEC細胞的分支點和毛細血管長度(圖4I-J)。CAM和主動脈環實驗表明circFIRRE也能促進血管生成(圖4K-L)。上述這些結果說明circFIRRE可促進腫瘤轉移時的新生血管形成。
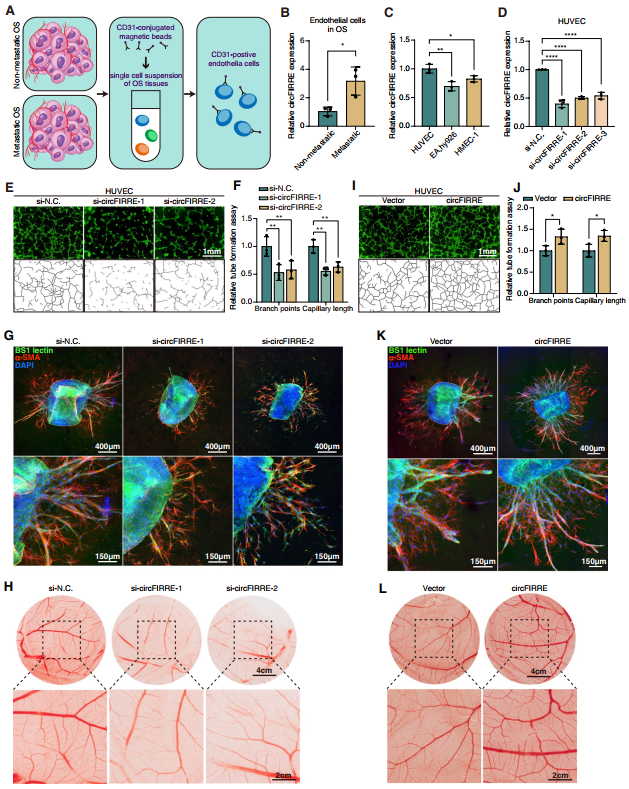
圖4 circFIRRE誘導體內、體外腫瘤轉移時的新生血管形成。
5. YY1調控OS中circFIRRE的表達
鑒于circFIRRE在OS中顯著上調,作者們假設circFIRRE在人類OS發育中受上游轉錄因子(TF)調控。作者從UCUS基因瀏覽器中檢索到FIRRE的啟動子,用三種算法來預測能與啟動子結合的潛在的TFs,發現Yin Yang 1(YY1)是這些算法中僅有的轉錄因子(圖5A)。然后檢測了35對OS樣本中YY1的表達水平,發現相對于相鄰的正常對照,circFIRRE在OS樣本中高表達,并且與circFIRRE的表達水平呈正相關(圖5B-C)。在細胞水平上,相比于hFOB1.19細胞,MG63和U2OS細胞YY1表達相對上調(圖5D)。隨后,作者將circFIRE的啟動子序列與JASPAR中的YY1結合基序進行比對,預測circFIRE啟動子中2個可能的YY1結合位點(圖5E),并利用雙熒光素酶報告基因實驗驗證了2個可能的結合位點。在野生型(WT)組中,過表達YY1后,circFIRRE啟動子的熒光素酶活性增強,而結合位點1或2的突變部分挽救了這種增強效應,而同時突變結合位點1和2時,熒光素酶活性沒有顯著變化(圖5F)。為探究YY1對circFIRRE和linearFIRRE表達變化的影響,作者設計了3條YY1的siRNA,并選擇敲低效果較好的si-YY1-1進行后續實驗(圖5G)。YY1敲低后,circFIRRE在MG63和U2OS中的表達顯著下調,而線性FIRRE表達下調幅度最小,說明兩組間無顯著性差異(圖5H-I),YY1過表達是相反的結果(圖5J-L)。這些結果表明YY1的轉錄調控作用很可能主要是針對circFIRRE,而不是對線性FIRRE的調控。即:YY1可能是OS中circFIRRE轉錄的激活因子。
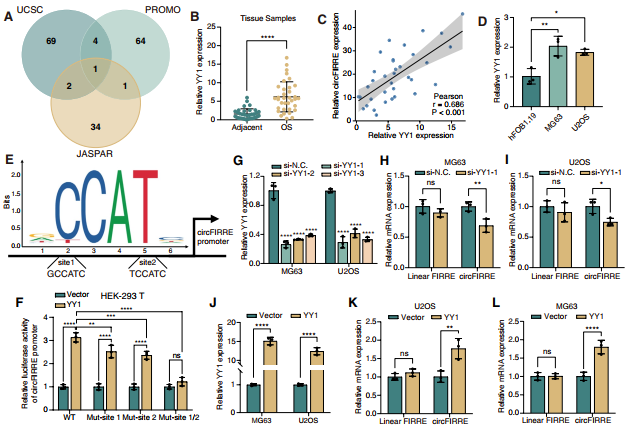
圖5 YY1激活circFIRRE轉錄。
6. circFIRRE在OS細胞中海綿miR-486-3p和miR-1225-5p
鑒于circFIRRE主要在細胞質中表達,作者推測circFIRRE可能作為miRNA海綿中和miRNA介導的基因沉默。首先,針對RNA誘導沉默復合物(RISC)的核心成分AGO2(氬氣RISC催化組件2)蛋白進行RNA免疫沉淀。結果顯示,circFIRRE被AGO2 pull down特異性富集,而非免疫球蛋白G(IgG)(圖6A-C),提示circFIRRE可能與RISC結合并海綿化相應的miRNA。然后應用了五種算法預測circFIRE的潛在靶miRNA,并從數據庫間的重疊中確定miR-486-3p和miR-1225-5p為候選miRNA(圖6D)。RT-qPCR檢測circFIRRE對miR-486-3p和miR-1225-5p表達水平的影響。結果表明,這兩個miRNAs在35個配對的OS樣本和細胞系中相對于鄰近的正常對照和成骨細胞的表達顯著下調(圖6E),并且與circFIRRE表達呈負相關(圖6H-I)。FISH實驗進一步證實了這種模式(圖6F-G)。然后,通過circFIRRE敲低(si-circFIRRE-1)顯著上調miR-486-3p和miR-1225-5p的表達水平,反之下調miR-486-3p和miR-1225-5p的表達水平(圖6J-K)。這些結果表明miR-486-3p和miR-1225-5p在OS中相對低表達,并受circFIRRE的負調控。
此外,利用特異性生物素標記的circFIRRE探針,通過pull-down實驗研究circFIRRE是否可以直接結合這兩個miRNAs。結果發現,相對于寡核苷酸探針,circFIRRE探針能夠特異性富集細胞裂解液中的circFIRRE、miR-486-3p和miR-1225-5p(圖6L-M)。pull-down實驗進一步驗證,與對照探針相比,特異性生物素標記的miR-486-3p和miR-1225-5p探針成功捕獲circFIRRE(圖6N-O)。將熒光素酶報告質粒與miR-486-3p或miR-1225-5p mimic共轉染HEK-293T細胞,進行雙熒光素酶報告實驗。結果顯示,與陰性對照miRNA相比,miR-486-3p和miR-1225-5p協同將熒光素酶活性至少降低50%。隨后從熒光素酶報告質粒中突變預測的miRNA結合位點,發現miRNA轉染后突變的熒光素酶活性保持不變(圖6P)。在MG63和U2OS細胞中,circFIRRE與相應的miRNAs通過雙重FISH實驗共定位,支持了上述結果(圖6Q-R)。所有這些發現表明circFIRRE可能作為miR-486-3p和miR-1225-5p的海綿發揮作用。
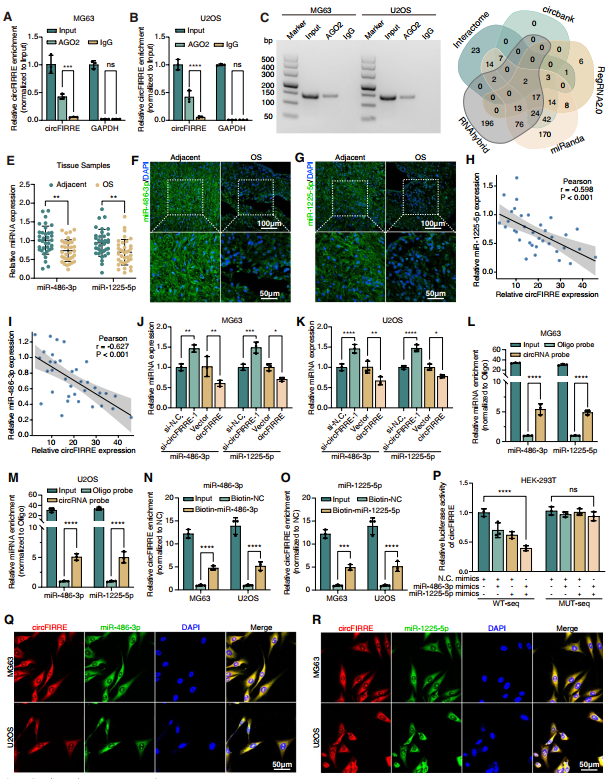
圖6 circFIRRE充當miR-486-3p和miR-1225-5p的海綿。
7. 體外circFIRRE通過miR-486-3p和miR-1225-5p-LUZP1軸促進骨肉瘤發生和新生血管形成
基于以前的研究,作者推測circFIRRE可能通過抑制兩種miRNA的保護作用,激活下游基因,促進骨肉瘤進展和新生血管形成。作者首先尋找miR-486-3p和miR-1225-5p在OS中的靶基因。通過3種預測算法(miRDB、TargetScan和RNAInter)和RNA-seq數據交叉分析,發現LUZP1(亮氨酸拉鏈蛋白1)是重疊基因中僅有的預測基因(圖7A)。RT-qPCR驗證正常鄰近樣本相比,LUZP1在35對臨床OS樣本中上調(圖7B),發現它們與miR-486-3p和miR-1225-5p表達水平呈負相關,與circFIRRE呈正相關(圖7C-E)。作者將熒光素酶報告質粒與miR-486-3p和miR-1225-5p mimic共轉染至HEK-293T細胞,研究這兩個miRNAs與LUZP1之間的相互作用。LUZP1 3′-UTR降低的熒光素酶活性伴隨著miRNA的過表達。相反,與LUZP1 3′-UTR突變后的對照相比,熒光素酶活性保持不變(圖7F)。研究采用RT-qPCR和Western blot進行拯救實驗。結果顯示,si-circFIRRE-1引起的內源性LUZP1下調在mRNA和蛋白水平被miR-486-3p或miR-1225-5p抑制劑部分挽救(圖7G-H)。Wound healing assay和Transwell遷移和侵襲實驗表明,miR-486-3p和miR-1225-5p抑制劑明顯消除對sh-circFIRRE-1細胞遷移和侵襲的抑制作用(圖7I-J)。此外,tube formation assay顯示miR-486-3p和miR-1225-5p抑制劑明顯增加了si-circFIRRE-1細胞中減少的分支點和毛細血管長度(圖7K-L)。總之,這些發現表明circFIRRE在體外至少部分通過miR-486-3p / miR-1225-5p-LUZP1通路促進OS進展和新生血管形成。

圖7 體外circFIRRE通過miR-486-3p和miR-1225-5p-LUZP1軸促進骨肉瘤發生和新生血管形成。
8. circFIRRE通過海綿化miRNA促進OS腫瘤的原位發生和體內轉移
為驗證circFIRRE-miR-486-3p / miR-1225-5p軸在體內的功能,研究構建原位異種移植瘤模型和尾靜脈轉移模型。將熒光染料標記的MG63細胞注入右脛骨骨髓腔,建立原位異種移植瘤模型(每組10個)。熒光素酶強度顯示circFIRRE敲低明顯降低原位腫瘤大小,抑制骨肉瘤細胞增殖,而miR-486-3p和miR-1225-5p抑制減輕這種損傷(圖8A)。在注射后5周進行micro-CT掃描和三維重建以評估腫瘤發生引起的骨破壞情況。結果表明,對照組出現嚴重的脛腓骨和關節破壞,sh-circFIRRE組骨破壞減輕,而miR-486-3p和miR-1225-5p海綿拯救了sh-circFIRRE的修復(圖8B)。注射后5周,處死小鼠,獲取OS病灶進行免疫組化(IHC)和蛋白分析。IHC結果顯示,細胞增殖標志物ki-67顯示腫瘤增殖活性減弱,間質標志物N-cadherin和顯示EMT能力受到抑制。在shcircFIRRE-1組中Vimentin和上皮標志物E-cadherin,而這些腫瘤特征被miRNA海綿拯救(圖8C)。在sh-circFIRRE-1組中觀察到LUZP1的蛋白水平相對于對照組下調,而在IHC和Western bolt分析中抑制miR-486-3p和miR-1225-5p部分消除了下調(圖8D-E)。
為了進一步研究circFIRRE如何調節腫瘤肺轉移和血管生成,作者通過將穩定的熒光素酶標記的MG63細胞注射到裸鼠的側尾靜脈中(每組10只小鼠),構建肺轉移模型。注射后4周,根據IVIS實驗中熒光素酶的強度,發現對照組小鼠肺野內有彌漫性轉移;sh-circFIRRE組的肺區相對清晰,無廣泛轉移;與sh-circFIRRE組相比,沉默miR-486-3p和miR-1225-5p顯著增加了肺轉移的程度和轉移病灶的大小(圖8F)。同樣,micro -CT掃描和三維重建顯示,與對照組相比,sh-circFIRRE組的腫瘤體積和數量顯著減少(圖8G-I),而與sh-circFIRRE組相比,sh-circFIRRE和miRNAs海綿組的轉移病灶體積和數量增加。切除的肺在光照和hematoxylin和伊紅染色下的照片進一步證實這一結論(圖8J-K)。轉移OS中VEGF和CD31染色顯示,對照組和miRNAs海綿組的血管生成均被顯著激活,而在sh-circFIRRE-1組中血管生成被抑制(圖8L-M)。IHC和Western blot驗證轉移灶中LUZP1表達的相應變化(圖8N-O)。所有這些發現表明circFIRRE通過在體內吸附miR-486-3p / miR-1225-5p促進骨肉瘤的原位生長、肺轉移和血管生成。
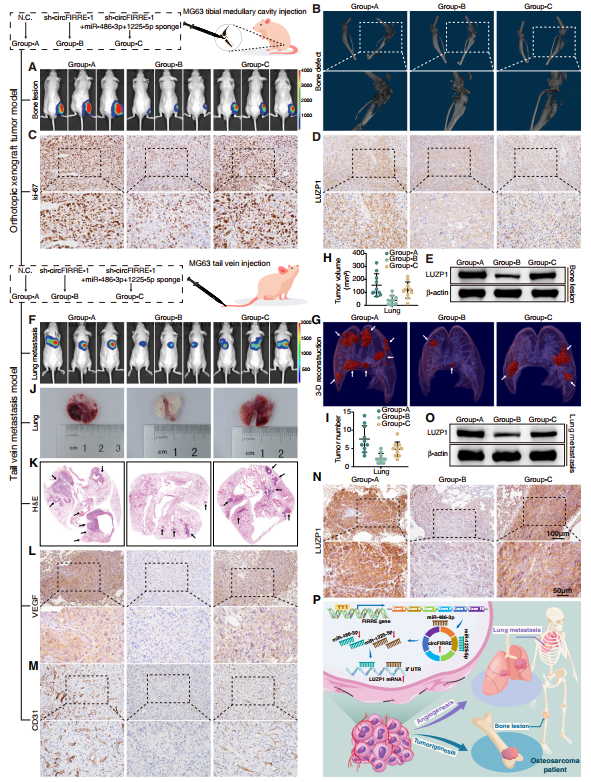
圖8 circFIRRE通過海綿化miRNAs促進OS腫瘤的原位發生和體內轉移。
結論
總之,與相鄰的正常樣本相比,OS患者樣本中circFIRRE表達上調。circFIRRE表達升高與不良臨床表現呈正相關。體外和體內初步驗證了YY1-circFIRRE-miR-486-3p/ miR-1225-5p-LUZP1通路在OS中的調控作用。研究首次闡明circFIRRE在OS腫瘤發生和血管生成中的作用,可能為難治性OS等腫瘤中circRNAs的分子生物學、診斷和治療研究提供有用的參考。
參考文獻
Yu L, Zhu H, Wang Z, Huang J, Zhu Y, Fan G, Wang Y, Chen X, Zhou G. (2022) Circular RNA circFIRRE drives osteosarcoma progression and metastasis through tumorigenic-angiogenic coupling. Mol Cancer. 21(1):167. doi: 10.1186/s12943-022-01624-7.






