METTL14介導的circORC5的m6A修飾通過調節miR-30c-2-3p/AKT1S1軸抑制胃癌進展
N6-甲基腺苷(m6A) RNA甲基化和環狀RNAs (circRNAs)在包括胃癌(GC)在內的多種惡性腫瘤中起著重要作用。然而,關于circRNAs的m6A修飾如何促進GC進展的知識很少。我們采用Western blot和免疫組化評估METTL14表達與胃癌患者臨床病理特征和預后的關系。通過體外和體內功能實驗研究METTL14在GC中的作用。通過RT-qPCR和Western blot分析,評估METTL14和(或)circORC5對miR-30c-2-3p介導的AKT1S1和EIF4B的影響。我們發現METTL14在胃癌組織樣本中表達下調,其低表達是胃癌患者生存不良的前兆因素。異位表達METTL14在體內外均能顯著抑制GC細胞的生長和侵襲,而敲除METTL14則具有相反的作用。機械上,m6A-circRNA轉錄微陣列和Me-RIP將circORC5識別為METTL14的下游靶點。沉默METTL14降低了circORC5的m6A水平,但增加了circORC5的表達。此外,circORC5可以海綿miR-30c-2-3p,并逆轉METTTL14引起的miR-30c-2-3p的上調以及AKT1S1和EIF4B的下調。circORC5與miR-30c-2-3p呈負相關,在GC中生存率較低。我們的研究結果表明,METTL14介導的circORC5的m6A修飾通過調節miR-30c-2-3p/AKT1S1軸抑制胃癌進展。本文于2022年2月發表于Molecular Cancer (IF=41.444)上。
技術路線:

主要研究結果:
(1) METTL14基因下調預示GC患者預后不良
為了研究METTL14在GC中的潛在作用,我們首先分析了TCGA的RNA測序數據。結果顯示,與正常組織相比,人類GC組織樣本中METTL14的表達降低了(圖1A,P<0.05)。我們進一步通過Western blot檢測了10個配對GC組織樣本中METTL14的蛋白水平,結果顯示,與配對正常樣本相比,GC中METTL14明顯下調(圖1B,C, P<0.0001)。組織芯片包含90對癌組織和匹配的正常組織,通過IHC染色分析,進一步驗證了GC組織中METTL14的下調(圖1D, P=0.029)。Kaplan-Meier分析發現,METTL14低表達患者的總生存率較高表達患者差(圖1E, P=0.042)。從GSE22377中提取TCGA和GC患者的臨床資料,建立獨立的兩個隊列。與我們的結果一致的是,低表達的METTL14在胃癌中的生存率較低(圖1E, P<0.01)。這些結果提示METTL14是GC患者的一個可靠的預后因子。
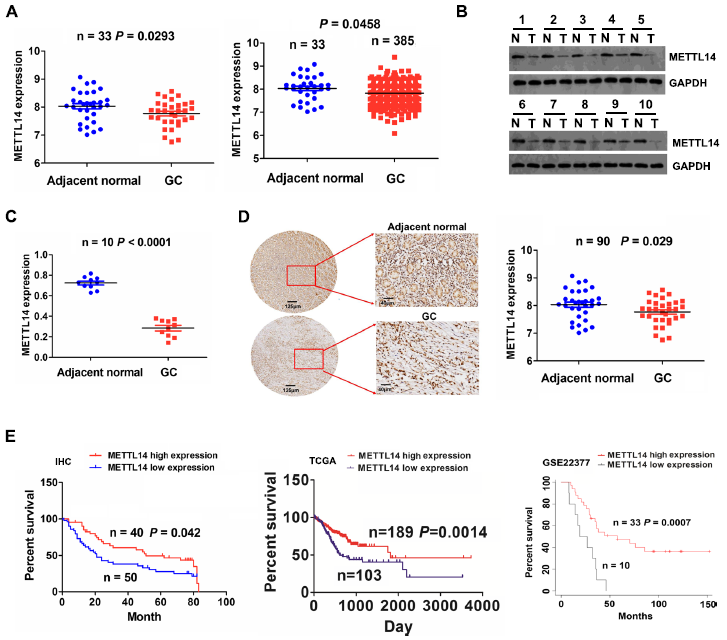
圖1:胃癌患者METTL14基因下調與預后不良相關。
(2) 敲除METTL14促進了GC的增殖和侵襲
鑒于METTL14在胃癌組織中的表達減少,我們推測METTL14可能在胃癌中起抑癌作用。我們通過RT-qPCR和Western blot檢測正常胃上皮細胞系(GES1)和GC細胞系(SGC-7901、MKN28、BGC-823、AGS和MGC-803)中METTL14的mRNA和蛋白水平,發現METTL14在AGS和MGC-803中高表達,而在SGC-7901中低表達(圖2A)。因此,為了確認METTL14在GC中的作用,我們用siRNA在AGC和MGC-803細胞中建立了METTL14敲除細胞模型,用質粒在SGC-7901細胞中建立了METTL14過表達細胞模型。通過RT-qPCR和Western blot檢測轉染效率(圖2B)。正如預期的那樣,METTL14的敲除顯著促進了細胞活力(圖2C)和增殖潛能(圖2D)。此外,Transwell侵襲實驗顯示,METTL14的下調顯著促進了GC細胞的侵襲能力(圖2E)。同樣,與對照組相比,過表達的METTL14對細胞活力(圖2C)、集落形成(圖2D)和侵襲能力(圖2E)均表現出抑制作用。
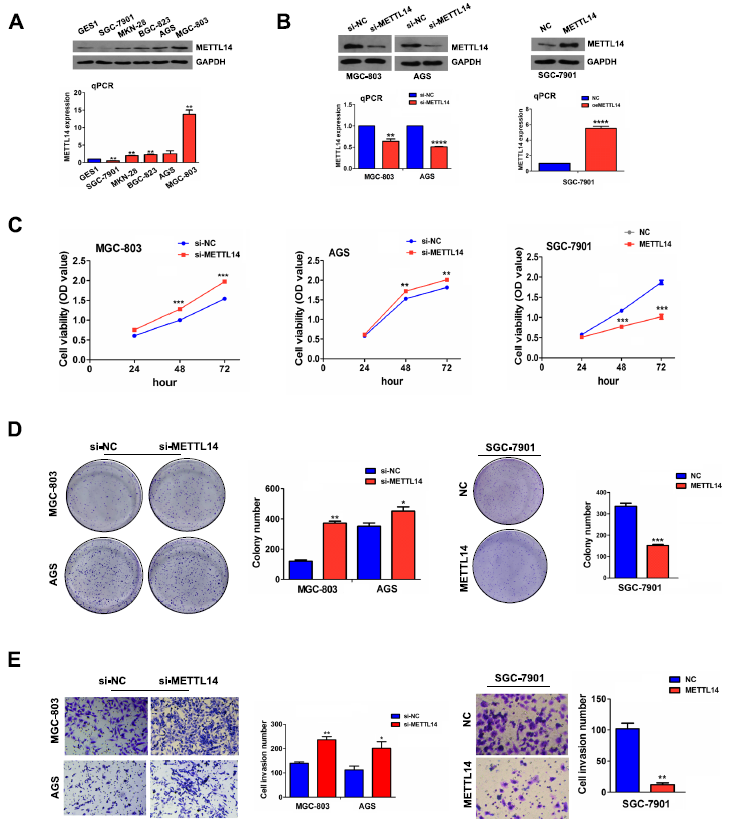
圖2:METTL14基因敲除促進GC增殖和侵襲。
(3) METTL14通過circORC5的m6A依賴性修飾發揮作用
為了闡明METTL14在GC進展中的潛在機制,我們首先通過MeRIP檢測了METTL14對MGC-803和AGS細胞中m6A水平的影響,結果顯示METTL14敲低的MGC803和AGS細胞中m6A水平明顯降低(圖3A)。m6A-circRNA轉錄芯片顯示,與對照組相比,METTL14敲低的MGC-803細胞中m6A水平升高的circRNAs有444個,m6A水平下降的circRNAs有454個(圖3B),其中,hsa_circ_0030632、hsa_circ_0047481和hsa_circ_007612是METTL14敲低的細胞中m6A水平下調最多的三個circRNAs (圖3C)。MeRIP-PCR進一步驗證了MGC-803和AGS細胞中,METTL14的敲除降低了hsa_circ_0007612 (circORC5)的m6A水平,而不是hsa_circ_0030632和hsa_circ_0047481的m6A水平(圖3D),而RT-qPCR分析顯示MGC-803和AGS細胞中METTL14的敲除提高了circORC5的mRNA水平(圖3E)。在功能上,我們發現circORC5的缺失降低了MGC-803和AGS細胞集落的形成和侵襲能力,并抵消了si-METTL14誘導的集落形成和侵襲潛能(圖3F,G)。這些結果表明,METTL14通過circORC5的m6A依賴性修飾發揮作用。
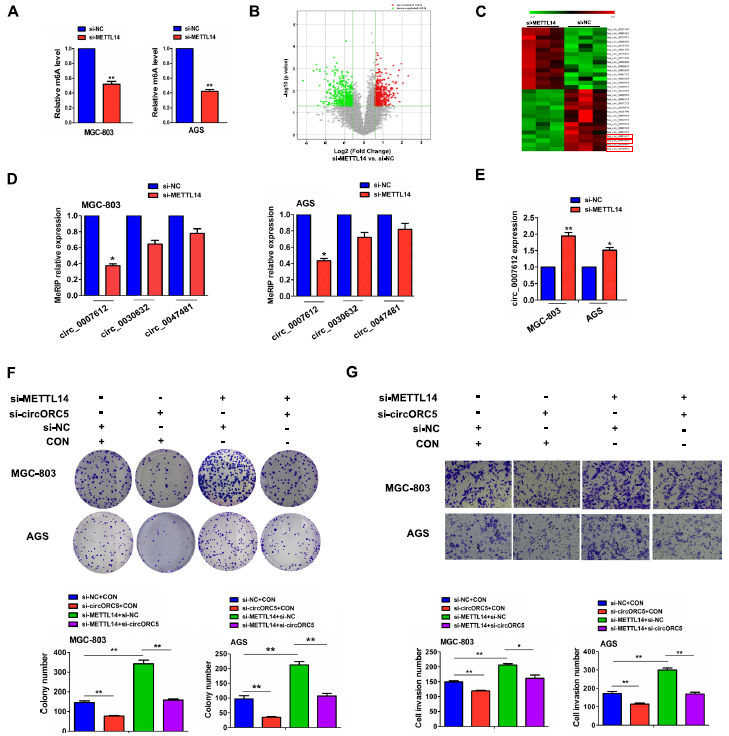
圖3:METTL14通過circORC5的m6A依賴性修飾發揮作用。
(4) GC中circORC5的鑒定及特征
根據環狀RNA交互組中的circRNA注釋,hsa_circ_0007612來源于線性基因起源識別復合體亞基5 (ORC5),命名為circORC5(圖4A)。與線性ORC5相比,經RNase R外切酶處理后,circORC5具有更高的穩定性(圖4B)。細胞質和核RNA分析顯示,circORC5在MGC-803和AGS細胞中優先定位在細胞質中(圖4C)。FISH進一步驗證了circORC5的綠色熒光分布主要在GC的細胞質中(圖4D),與相鄰正常組織相比,circORC5在GC組織中的表達增加(圖4E)。Kaplan-Meier發現,與circORC5低表達的GC患者相比,circORC5高表達的GC患者生存期較差(圖4F)。

圖4:circORC5的鑒定及特征。
(5) circORC5與GC中miR-30c-3p呈負相關
根據m6A-circRNA譜分析和miRbase,我們發現circORC5具有與5種miRNAs結合的潛力(圖5A)。我們分析了這五種miRNAs在GC中的表達水平,發現miR-30c-2-3p在387個未配對的GC組織和41個配對的GC組織中下降最為顯著(圖5B, P<0.0001)。FISH分析進一步證實,miR-30c-2-3p表達水平在GC組織中顯著下調,且與circORC5呈負相關(圖5C,D)。FISH分析表明,circORC5也定位于GC組織的細胞質中(圖5E)。
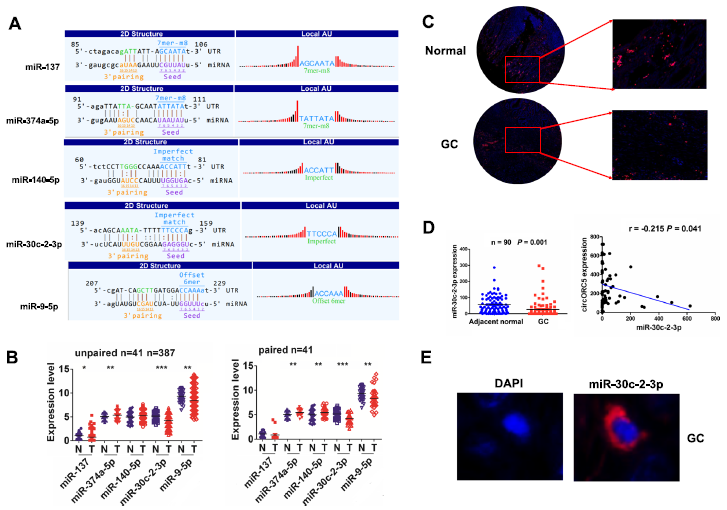
圖5:circORC5在GC中與miR-30c-2-3p呈負相關。
(6) circORC5在GC中充當miR-30c-2-3p的海綿
圖6A顯示了miR-30c-2-3p與circORC5的結合位點。我們發現,在MGC-803和AGS細胞中,與miR-NC組相比,miR-30c-2-3p模擬物可以降低WT circORC5 3'-非翻譯區(UTR)的熒光素酶活性,但對Mut circORC5 3'-UTR的熒光素酶活性沒有影響(圖6B)。RT-qPCR分析顯示,MGC-803和AGS細胞中,circORC5敲低或METTL14過表達可顯著增加miR30c-2-3p的表達(圖6C),但miR-30c-2-3p模擬物對circORC5表達無影響(補充圖未展示)。此外,我們在MGC-803和AGS細胞中對Ago2進行RNA免疫沉淀(RIP),并通過RT-qPCR分析從Ago2表達的細胞中拉下的內源性circORC5和miR-30c-2-3p水平,結果表明,與輸入對照組相比,Ago2顆粒中circORC5和miR-30c-2-3p高度富集(圖6D,E)。在功能上,miR-30c-2-3p抑制劑促進了MGC-803和AGS細胞的細胞活力,逆轉了circORC5敲除誘導的抗增殖作用(圖6F)。
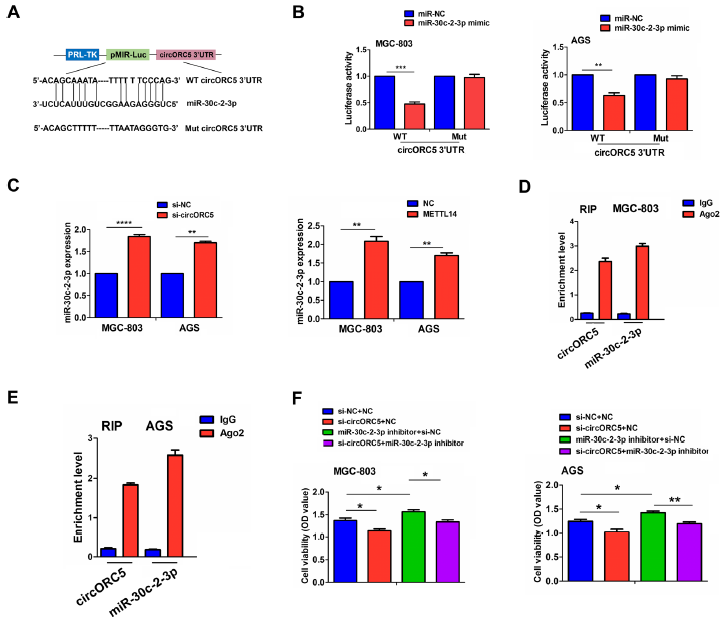
圖6:circORC5在GC中充當miR-30c-2-3p的海綿。
(7) METTL14介導circORC5調節miR-30c-2-3p/AKT1S1軸
為了驗證METTL14是否介導circORC5調節miR-30c-2-3p的表達,RT-qPCR分析顯示,在MGC-803和AGS細胞中,下調circORC5增加了miR-30c-2-3p的表達,逆轉了下調METTL14對miR-30c-2-3p表達的抑制作用(圖7A)。接下來,我們將AKT1底物1 (AKT1S1)和真核翻譯起始因子4B (EIF4B)確定為miR-30c-2-3p的靶點,并將miR-30c-2-3p與AKT1S1/EIF4B潛在結合位點的示意圖列出(補充圖未展示)。我們進一步發現,在MGC-803和AGS細胞中,與miR-NC組相比,miR-30c-2-3p模擬物可以降低WT AKT1S1和EIF4B 3’UTR的熒光素酶活性,但對Mut AKT1S1和EIF4B 3’UTR的熒光素酶活性沒有影響(圖7B,C)。同時,miR-30c-2-3p模擬物可下調AKT1S1和EIF4B的表達(圖7D,E)。進一步的Western blot顯示,METTL14敲低顯著上調MGC-803和AGC細胞中AKT1S1和EIF4B的表達,而這種影響可通過敲低circORC5逆轉(圖7E)。
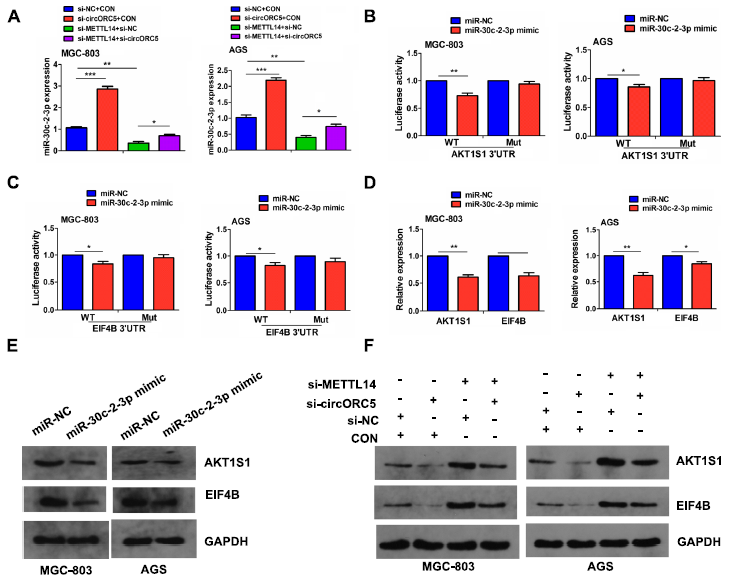
圖7:METTL14介導circORC5調節miR-30c-2-3p/AKT1S1軸。
為了研究METTL14在體內是否抑制腫瘤生長,我們建立了穩定轉染METTL14或NC的SGC-7901細胞系,然后將其皮下注射到裸鼠的腹部。觀察33天后,我們發現,轉染METTL14的SGC-7901細胞誘導的移植瘤體積小于轉染NC的細胞(圖8A)。生長曲線顯示,METTL14轉染組腫瘤呈時間依賴性減少(圖8B),與NC組相比,METTL14轉染組腫瘤體積和重量均有所減輕(圖8C)。HE和IHC染色顯示,與NC組相比,METTL14轉染組腫瘤增殖標志物Ki-67下調(圖8D)。
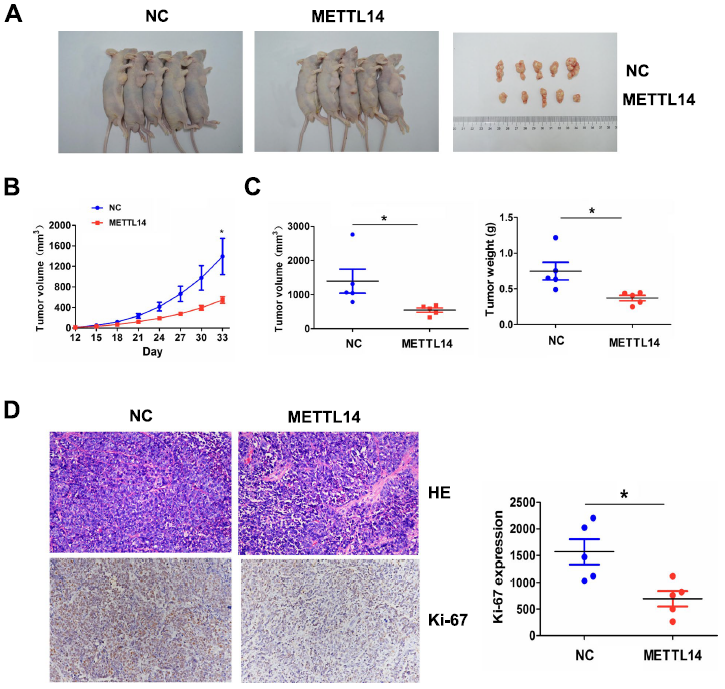
圖8:METTl14在體內抑制腫瘤生長。
結論:
在本研究中,我們發現miR-30c-2-3p或circORC5的敲除會降低ElF4B和AKT1S1的表達,circORC5的缺失逆轉了METTL14敲除對GC細胞中ElF4B和AKT1S1表達的促進作用。結果表明,METTL14通過提高circORC5的m6A水平和降低其表達來抑制GC的生長,circORC5海綿化miR-30c2-3p并上調ElF4B和AKT1S1,促進GC的腫瘤發生(圖9)。綜上所述,METTL14的下調與胃癌患者的生存率差相關,METTL14介導的circORC5的m6A修飾通過調節miR-30c-2-3p/AKT1S1軸抑制胃癌細胞的生長和侵襲,可能為胃癌提供一個有希望的預后因子。
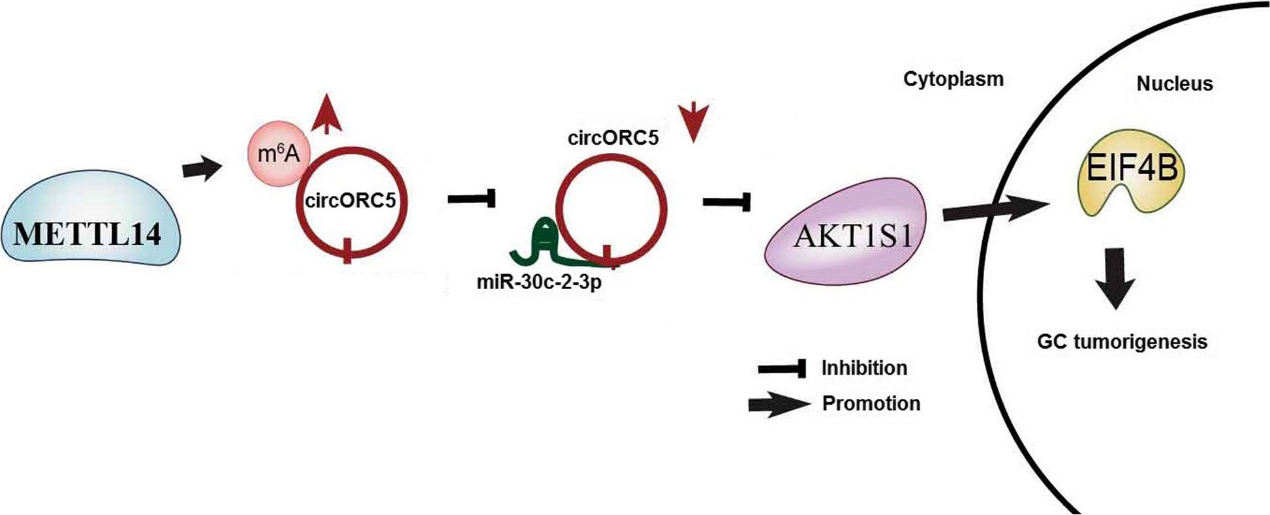
圖9:GC中的METTL14機制示意圖。METTL14增加了circORC5的m6A水平,抑制了circORC5的表達,從而上調了miR-30c-2-3p,下調了AKT1S1和EIF4AB,抑制了GC的進展。
參考文獻:Fan, H. N., Chen, Z. Y., Chen, X. Y., Chen, M., Yi, Y. C., Zhu, J. S., & Zhang, J. (2022). METTL14-mediated m6A modification of circORC5 suppresses gastric cancer progression by regulating miR-30c-2-3p/AKT1S1 axis. Molecular cancer, 21(1), 51. https://doi.org/10.1186/s12943-022-01521-z.






