m6A輕松發(fā)6分 還不快學(xué)起來!
大多數(shù)局限性人腎透明細(xì)胞癌(ccRCC)相關(guān)的死亡是由于癌癥的復(fù)發(fā)和轉(zhuǎn)移。然而,精確的分子機(jī)制在很大程度上仍是未知的。近年來,越來越多的lncRNA被證明是腫瘤發(fā)生的重要調(diào)控因子。本研究發(fā)現(xiàn)lncRNA DUXAP9具有預(yù)后價值,其m6A修飾通過激活PI3K/AKT信號通路促進(jìn)腎癌細(xì)胞的增殖和運動。因此認(rèn)為DUXAP9可能是一種有用的預(yù)后標(biāo)志物和ccRCC的潛在治療靶點。本研究于2021年6月發(fā)表在《Frontiers in Oncology》IF:6.244期刊上。
技術(shù)路線:

主要實驗結(jié)果:
1、lncRNA DUXAP9在局限性ccRCC中上調(diào)并與不良預(yù)后呈正相關(guān)
首先檢測了來自SYSUCC生物庫的112對原發(fā)性局限性ccRCC和鄰近非腫瘤組織中DUXAP9的表達(dá)。結(jié)果顯示,與癌旁非腫瘤組織相比,DUXAP9在ccRCC組織中表達(dá)增加(Figure 1A)。利用X-tile軟件(基于積分光密度),獲得了將這些患者分為高表達(dá)組和低表達(dá)組的截斷值(Figure 1B)。此外,Kaplan-Meier分析表明,DUXAP9上調(diào)與較差的OS和PFS顯著相關(guān)(Figures 1C, D)。Umrc6和Caki-1細(xì)胞株中DUXAP9的表達(dá)明顯高于其他細(xì)胞株。使用FISH和亞細(xì)胞分離實驗證實DUXAP9不僅定位于Umrc6細(xì)胞的細(xì)胞核,而且也定位于細(xì)胞質(zhì)(Figures 1F, G)。

為了驗證上述結(jié)果,分析了TCGA數(shù)據(jù)在445個局限性ccRCC組織和72個正常腎組織中DUXAP9的表達(dá)情況。與正常腎組織相比,DUXAP9在局限性ccRCC中顯著上調(diào)(Figure 2A)。此外,如Figures 2B-D的小提琴圖所示,DUXAP9在局限性ccRCC中的表達(dá)隨著T分級(P=0.011)、分期(P=0.010)和分級(P=0.027)的增加而增加。此外,DUXAP9上調(diào)與較差的OS和PFS相關(guān)(Figures 2E, F)。
綜上所述,DUXAP9在局限性ccRCC中上調(diào)表達(dá)并與不良預(yù)后呈正相關(guān)。

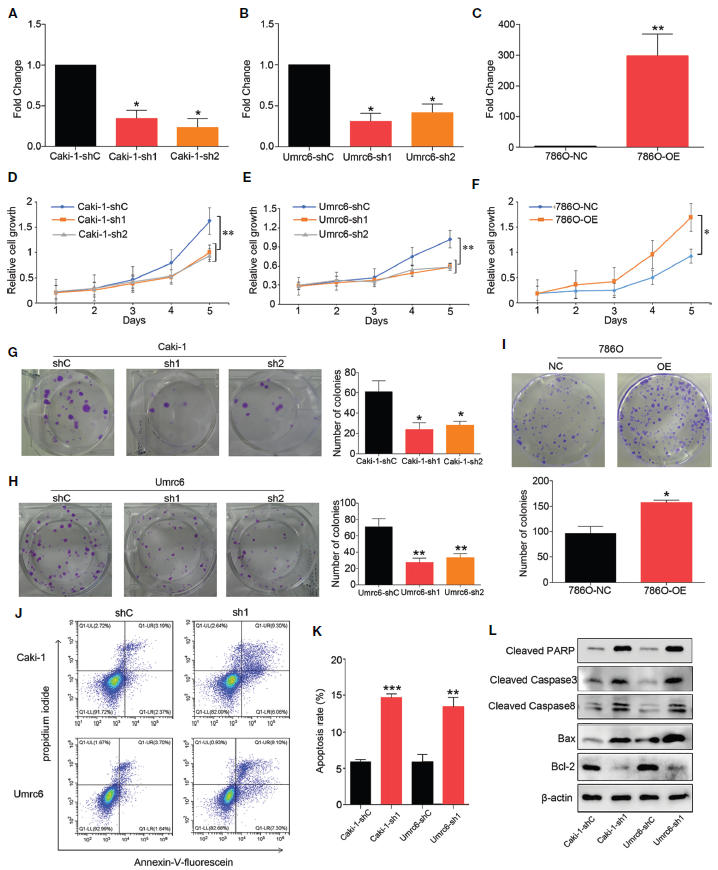
2、DUXAP9促進(jìn)RCC細(xì)胞增殖,抑制細(xì)胞凋亡
為了確定DUXAP9上調(diào)對局限性ccRCC的影響,在Umrc6和Caki-1細(xì)胞中使用靶向DUXAP9的shRNA敲除DUXAP9 (Figures 3A, B),并在786-O細(xì)胞中過表達(dá)DUXAP9 (Figures 3C)。CCK-8和菌落形成實驗表明,DUXAP9敲低可顯著抑制Umrc6和Caki-1細(xì)胞的增殖,過表達(dá)DUXAP9可顯著增加786-O細(xì)胞的增殖(Figures 3D-I)。此外,DUXAP9敲除后,均可在Umrc6和Caki-1細(xì)胞中觀察到細(xì)胞凋亡。因此,作者想知道DUXAP9是否可以調(diào)節(jié)細(xì)胞凋亡,導(dǎo)致細(xì)胞增殖。流式細(xì)胞術(shù)顯示DUXAP9敲除后腎癌細(xì)胞的凋亡率明顯升高(Figures 3J, K),且DUXAP9敲除后,抗凋亡蛋白Bcl-2顯著降低,促凋亡蛋白Bax、cleaved caspase-8、cleaved caspase-3、cleaved PARP顯著升高(Figure 3L)。這些結(jié)果證實了DUXAP9是一種重要的凋亡介質(zhì)。
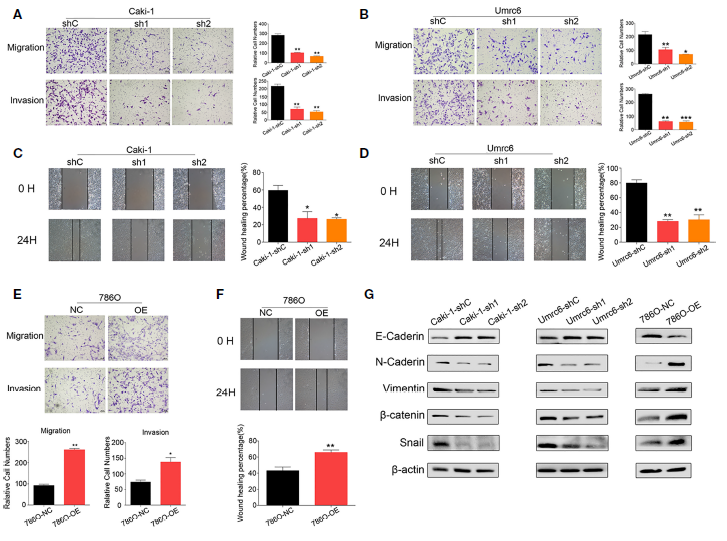
3、DUXAP9促進(jìn)RCC細(xì)胞遷移和侵襲,參與EMT
進(jìn)一步探討了DUXAP9對腎癌細(xì)胞遷移和侵襲的影響,結(jié)果顯示, DUXAP9下調(diào)顯著抑制Caki-1和Umrc6細(xì)胞的體外遷移和侵襲能力;與對照細(xì)胞相比,DUXAP9在786-O細(xì)胞中的過表達(dá)顯著增加了細(xì)胞的遷移和侵襲能力(Figures 4A–F)。由于EMT在晚期腫瘤的運動能力中起著至關(guān)重要的作用,作者評估了RCC中的DUXAP9是否激活EMT通路。如預(yù)期的那樣,DUXAP9敲除Caki-1和Umrc6細(xì)胞后,N-cadherin、vimentin、β-catenin和Snail水平下降,而E-cadherin水平升高。相反,在786-O細(xì)胞中過表達(dá)DUXAP9后,E-cadherin水平下調(diào),而N-cadherin、vimentin、β-catenin和Snail水平上調(diào)(Figures 4G)。以上結(jié)果表明DUXAP9促進(jìn)RCC細(xì)胞遷移和侵襲,參與EMT。
4、IGF2BP2通過依賴m6A的方式提升DUXAP9的穩(wěn)定性
為了研究DUXAP9調(diào)控RCC的潛在分子機(jī)制,采用RNA pull-down和質(zhì)譜分析來鑒定與DUXAP9結(jié)合的蛋白。在Caki-1細(xì)胞中,IGF2BP2直接與DUXAP9結(jié)合而不是反義對照 (Figure 5A)。此外,RIP-qPCR檢測驗證了在Caki-1細(xì)胞中IGF2BP2和DUXAP9之間的相互作用,使用IGF2BP2特異性抗體與對照IgG抗體比較,證實了DUXAP9的富集(Figure 5B)。IGF2BP2是一種RNA結(jié)合蛋白,被稱為m6A閱讀器,以依賴m6A的方式增強RNA的穩(wěn)定性。
利用SRAMP(一種m6A修飾位點預(yù)測器)在DUXAP9序列中發(fā)現(xiàn)了一個經(jīng)典的m6A基序(GAACT),因此作者想知道DUXAP9是否表現(xiàn)出m6A修飾,這可以維持其在腎癌細(xì)胞中的命運。MeRIP檢測和qPCR分析顯示,在Caki-1細(xì)胞中,DUXAP9與對照IgG抗體相比高度富集,證實了DUXAP9中m6A修飾(Figure 5C)。此外,通過pull-down檢測,DUXAP9中m6A基序的突變降低了IGF2BP2的結(jié)合(Figure 5D)。這說明IGF2BP2與DUXAP9的結(jié)合依賴于m6A修飾。
為了探究IGF2BP2是否影響了DUXAP9在RCC中的穩(wěn)定性,在Caki-1和Umrc6細(xì)胞中敲除IGF2BP2或METTL3,發(fā)現(xiàn)DUXAP9的水平一開始是下降的(Figures 5E, F)。然后,用轉(zhuǎn)錄抑制劑更生霉素處理IGF2BP2 敲除細(xì)胞,證實DUXAP9的半衰期顯著降低(Figures 5G, H)。同時,當(dāng)敲除METTL3時,一種重要的m6A甲基轉(zhuǎn)移酶,被稱為m6A writer,METTL3在Caki-1和Umrc6細(xì)胞中的抑制作用使DUXAP9的半衰期顯著縮短(Figures 5I, J)。此外,在METTL3敲除后,與對照IgG抗體相比,使用IGF2BP2-或m6A特異性抗體時,DUXAP9在RIP-qPCR檢測中的富集顯著降低(Figures 5K, L)。這些結(jié)果表明,IGF2BP2在腎癌細(xì)胞中與DUXAP9結(jié)合,并以m6A依賴的方式促進(jìn)DUXAP9的穩(wěn)定性。

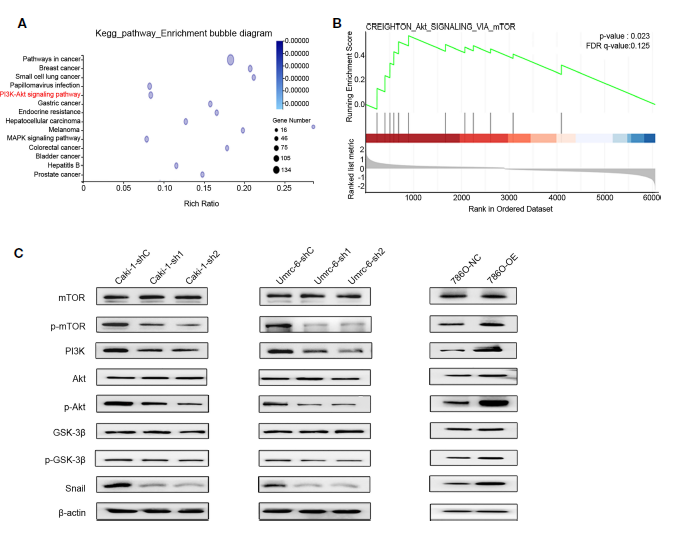
5、DUXAP9激活腎癌細(xì)胞中PI3K/Akt信號通路和Snail表達(dá)
為了確定DUXAP9在RCC中的潛在作用機(jī)制,對DUXAP9敲除的Caki-1細(xì)胞和對照Caki-1細(xì)胞進(jìn)行RNA測序,然后進(jìn)行KEGG富集分析(Figure 6A)。發(fā)現(xiàn)DUXAP9與Akt信號通路相關(guān),與TCGA數(shù)據(jù)的GSEA結(jié)果一致(Figure 6B)。此前有報道稱,通過激活Akt信號通路促進(jìn)EMT在腫瘤進(jìn)展中發(fā)揮重要作用。作者探討了DUXAP9是否參與了Akt誘導(dǎo)的EMT、腫瘤生長和侵襲。Western blotting證實與對照細(xì)胞相比,DUXAP9敲除的Caki-1和Umrc6細(xì)胞PI3K、p-Akt和p-mTOR下調(diào)。與此相反,在786-O細(xì)胞中DUXAP9過表達(dá)上調(diào)了這些蛋白的表達(dá)(Figure 6C)。
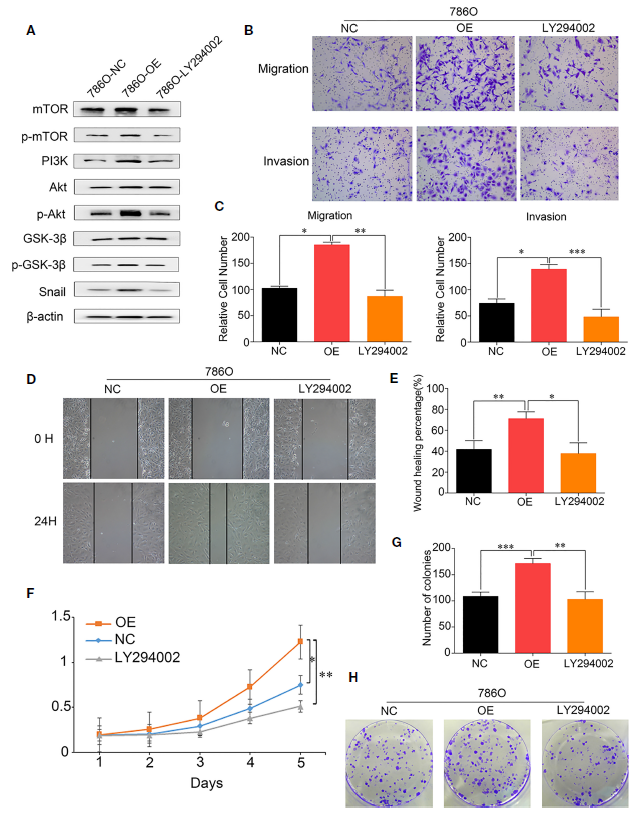
為了進(jìn)一步研究DUXAP9對RCC中Akt信號通路影響的機(jī)制,使用PI3K抑制劑LY294002試圖消除DUXAP9過表達(dá)對Akt信號通路的影響。用終濃度為20 μmol/L的LY294002培養(yǎng)24 h,隨后Western blotting分析顯示,LY294002可以抑制之前上調(diào)的p-mTOR、p-Akt、p-GSK3β和Snail的表達(dá)水平,并伴有DUXAP9過表達(dá)(Figure 7A)。Transwell細(xì)胞遷移/侵襲和傷口愈合實驗證實LY294002的使用顯著限制了DUXAP9過表達(dá)對體外遷移和侵襲能力的影響(Figures 7B–E)。通過CCK-8試驗和集落形成試驗證實了LY294002處理腎癌細(xì)胞也會削弱DUXAP9過表達(dá)細(xì)胞的腫瘤細(xì)胞生長進(jìn)程(Figures 7F–H)。
參考文獻(xiàn):
Tan L, Tang Y, Li H, Li P, Ye Y, Cen J, Gui C, Luo J, Cao J, Wei J. N6-Methyladenosine Modification of LncRNA DUXAP9 Promotes Renal Cancer Cells Proliferation and Motility by Activating the PI3K/AKT Signaling Pathway. Front Oncol. 2021 Jun 8;11:641833. doi: 10.3389/fonc.2021.641833. PMID: 34168980; PMCID: PMC8217835.






