褪黑素和維替泊芬通過調節線粒體動力學協同抑制頭頸部鱗狀細胞癌的生長和干細胞特性
頭頸部鱗狀細胞癌(HNSCC)是一種發生于口腔、咽和喉部的惡性腫瘤,其5年生存率大約只有50%,研究與腫瘤發生和轉移相關的潛在機制是發展HNSCC治療的關鍵。腫瘤干細胞(CSCs)具有無限的自我更新能力和腫瘤啟動能力,參與了HNSCC的腫瘤進展、治療耐藥性和復發,而靶向CSC相關通路的藥物是癌癥治療的顯著療法。目前,有研究發現褪黑素(Mel)和維替泊芬(VP)具有抗腫瘤作用,可調節線粒體自噬,減弱EMT和相關干細胞特性。該研究發表在《JOURNAL OF PINEAL RESEARCH》,IF:13.007。
技術路線:
主要研究結果:
1. HNSCC CSCs在低ROS水平和腫瘤球體形成能力的細胞培養中富集
在許多類型的癌細胞中,ROS水平可用于豐富CSC群體,因為CSC居住在相對較低的ROS條件下,以維持靜止和自我更新。此外,在3D培養中生長的癌細胞由于不均勻地暴露于氧氣和營養物質,可表現出增加的致瘤表型。因此,采用低生理活性氧水平和球體形成特性的細胞培養來研究HNSCC中的CSC亞群(圖1)。在正常細胞中,CD44+CD24-和CD133+細胞亞群分別為10.1%和1.14%(圖1A)。用CellROX對低活性氧和高活性氧種群分類,細胞內ROS水平被廣泛地用于豐富CSC(圖1B)。細胞分選后, CD44+CD24和CD133+細胞(ROS-low細胞)明顯高于CD44+CD24和CD133+細胞(ROS-high細胞)和正常細胞(圖1C-E)。ROS-low細胞表現出由CPDL和順鉑耐藥性(cisplatin)決定的CSC特性(圖1F,G)。同樣, CD44+CD24細胞和CD133+細胞數量分別增加了42.9%和3.41%(圖1H-J)。3D培養的SCC-25細胞對順鉑的耐藥性增強(圖1K)。這些結果表明,在3D培養以及低水平ROS的條件下,HNSCC培養物含有豐富的干細胞群,并表現出CSC樣特性。
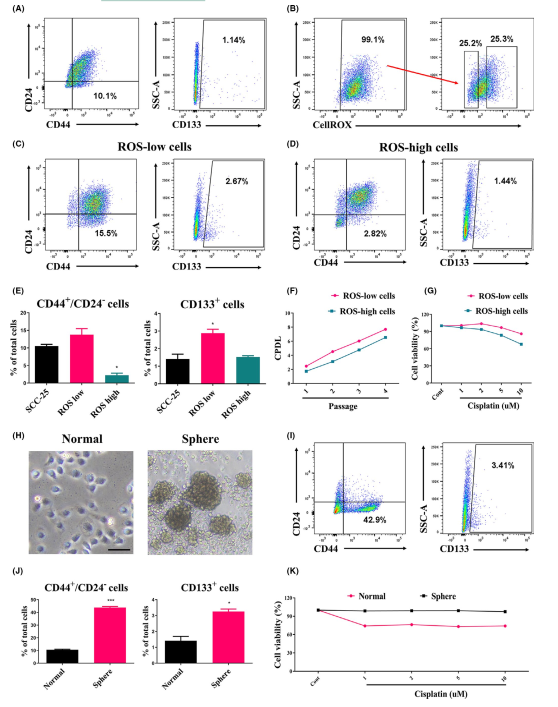
圖1 在ROS-low和球形細胞培養中CSCs的特性
2. Mel和VP聯合處理可誘導細胞凋亡,降低HNSCC細胞的CSC樣特性
為了證明Mel和VP對HNSCC生長的影響,分析了Mel或VP處理后SCC-25細胞的細胞活力(圖2A)。單用Mel或VP以劑量依賴的方式抑制細胞活力(圖2A)。無論細胞ROS水平如何,Mel (1 mM)和VP (2.5 μm)聯合處理對HNSCC細胞活性有協同作用(圖2B)。盡管聯合治療組中觀察到pAkt/Akt的表達呈下降趨勢,但治療并未改變pAkt/Akt的表達。在聯合治療組中,Cleaved Cas-3/Cas-3表達上調,表明Mel和VP促進HNSCC細胞凋亡(圖2C,D)。治療后進一步觀察SCC-25細胞的CSCs特征。Mel和VP單獨處理降低了細胞的成球能力,增加了細胞的線粒體ROS水平(圖2E-J)。此外,聯合處理大大降低了細胞的成球能力和CSC數量,而增加線粒體ROS的產生(圖2E-J)。這些結果表明,Mel和VP抑制了HNSCC細胞的活力,并降低了HNSCC的特性和種群數量。
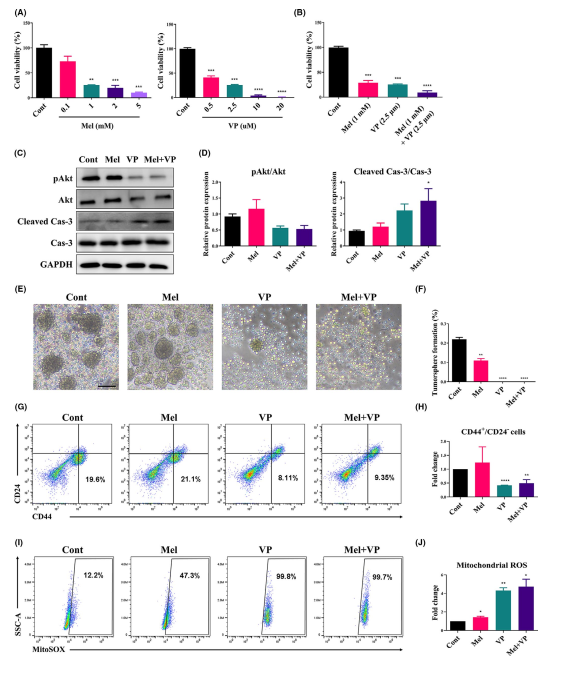
圖2 Mel和VP對CSC性能的影響
3. Mel和VP抑制與線粒體自噬相關基因的表達
由于線粒體自噬與癌細胞的增殖和死亡有關,進一步研究了Mel和VP對SCC-25細胞中參與線粒體自噬的基因表達的影響(圖3)。VP單獨降低了PINK1的表達,與Mel聯合顯著降低了PINK1和parkin的表達(圖3A,B)。用Mel和VP處理ROS低和ROS高的SCC-25細胞,研究其對細胞自噬的調節作用。兩種ROS分類的細胞與正常的SCC-25細胞表現出相似的模式(圖3C-F)。聯合治療降低了PINK1和parkin的表達,而與細胞內ROS水平無關。然而,線粒體網絡相關蛋白FIS1(線粒體分裂)的片段化并未因治療而改變(圖3A-F)。綜上所述,這些結果表明Mel和VP通過線粒體自噬而不改變線粒體分裂來抑制HNSCC的生存能力。
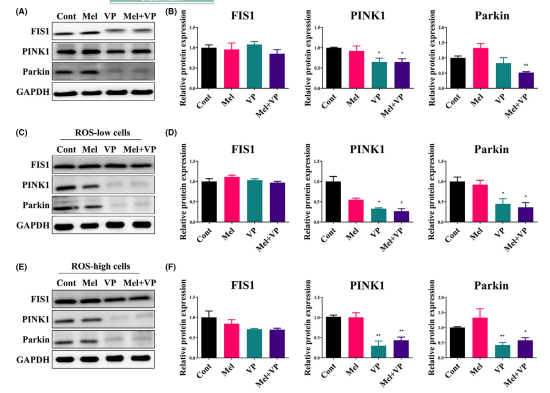
圖3 Mel和VP治療后對線粒體自噬的調節
4. Mel和VP可誘導線粒體功能障礙,減少線粒體自噬
使用TMRE(線粒體膜電位)染色標記活性線粒體,以顯示Mel和VP在線粒體損傷中的作用。Mel或VP單獨降低線粒體膜電位,它們的結合協同使線粒體失活(圖4A,B)。此外,用parkin和TOM20對細胞進行染色,觀察ROS-low和ROS-high細胞的線粒體形態和線粒體自噬的表達(圖4C,D)。聯合治療降低了ROS-low和ROS-high細胞中parkin和TOM20的表達。染色結果顯示,對照組的parkin/TOM20表達主要集中在細胞質中。該治療改變了相互連接的線粒體網絡,并將parkin/TOM20移至靠近細胞核的位置(圖4C)。這些數據表明,Mel和VP觸發線粒體損傷,導致線粒體自噬減少。
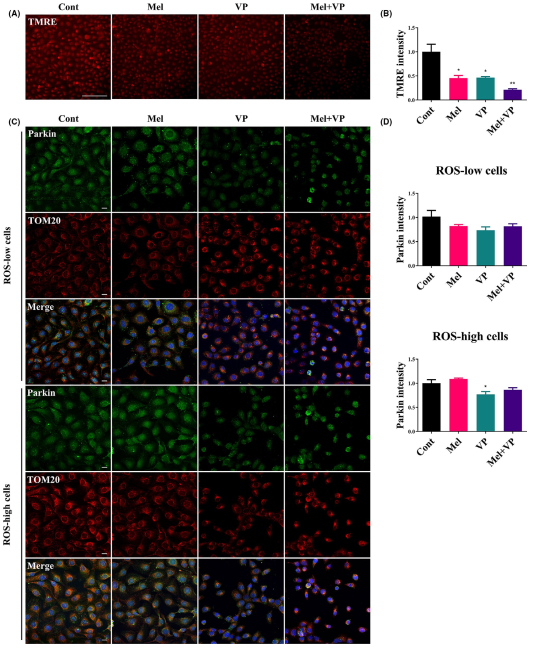
圖4 Mel和VP治療后線粒體功能和線粒體自噬的研究
5. Mel和VP對HNSCC的抑制作用是通過調節YAP信號和PINK1依賴的線粒體動力學介導的
為了研究Mel和VP與YAP信號轉導的相關性,分析了Mel和VP處理后SCC-25細胞中YAP靶基因CCN1的表達(圖5A-C)。Mel和VP單獨降低了CCN1的RNA表達(圖5A)。Mel和VP共同作用后,CCN1在mRNA和蛋白水平上的表達均顯著降低(圖5A-C),說明Mel和VP可能直接下調YAP信號轉導,導致YAP靶基因CCN1的表達下降。MPP+ iodide(碘化物)進一步證實了線粒體功能障礙對HNSCC的影響。MPP+ iodide抑制線粒體復合物I,并消耗內源性PINK1,導致線粒體損傷。MPP+ iodide以劑量依賴性的方式顯著降低細胞活力(圖5D)。進一步評估MPP+ iodide處理的SCC-25細胞中CD44+CD24細胞的百分比(圖5E,F)。MPP+ iodide未改變CD44+CD24細胞群。這些結果表明,抑制PINK1可導致HNSCC細胞死亡,而不影響干細胞數量。
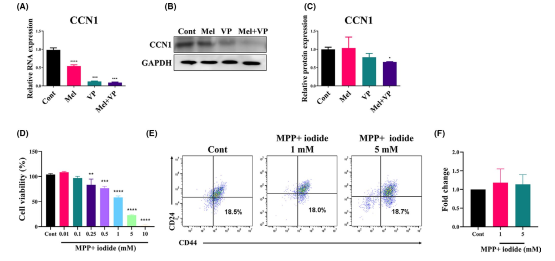
圖5 Mel和VP對YAP信號轉導的調控及PINK1依賴線粒體動力學的抑制作用
6. Mel和VP抑制HNSCC的上皮間質轉化和遷移
EMT在促進腫瘤的侵襲轉移方面起著重要作用。為了進一步驗證Mel和VP對EMT介導的腫瘤進展的影響,分析了SCC-25細胞中上皮和間充質標志物的表達(圖6A,B)。TGF-β1誘導SCC-25細胞發生EMT:包括Vim和N-cad在內的間質標志物在TGF-β1作用下表達升高,而E-cad在TGF-β1作用下表達略有降低(圖6A,B)。聯合治療組間充質標志物的表達顯著降低,而上皮標志物的表達在各治療組中略有恢復(圖6A,B)。傷口愈合實驗結果表明,Mel或VP均顯著減少了傷口愈合面積。此外,聯合治療后細胞很少增殖并遷移到劃傷區域(約4%)(圖6C,D)。在Transwell遷移實驗中,Mel和VP減少了向上腔室下表面遷移的細胞數量(圖6E,F)。此外,與癌癥侵襲轉移相關的MMP-2和MMP-9在Mel和VP處理的細胞中表達下調(圖6G,H)。這些發現提示Mel和VP可能是HNSCC中EMT、遷移和轉移的關鍵調控因子。
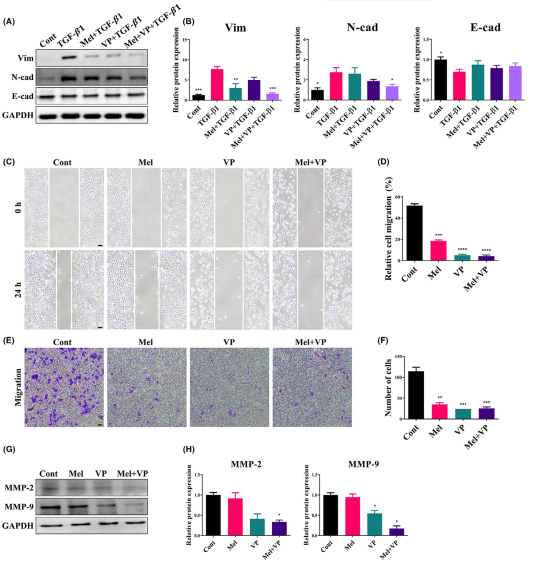
圖6 Mel和VP治療后EMT和轉移的調節作用
主要研究結論:
綜上所述,研究結果表明ROS-low HNSCC細胞和HNSCC的3D球形培養物表現出增強的CSC特性。此外,Mel和VP通過調節HNSCC中的PINK1/parkin/TOM20軸,導致線粒體損傷和線粒體吞噬功能降低。Mel和VP聯合治療通過調節EMT減少癌細胞轉移。因此,Mel和VP聯合治療可能是HNSCC患者的潛在治療策略。






