CAF分泌的miR-522可抑制鐵死亡并促進胃癌獲得性耐藥
欄目:最新研究動態
發布時間:2020-07-21
鐵死亡(Ferroptosis)是一種調控細胞死亡的新形式,涉及鐵依賴性脂質過氧化物(脂質-ROS)的積累,并導致細胞致命性損害...
鐵死亡(Ferroptosis)是一種調控細胞死亡的新形式,涉及鐵依賴性脂質過氧化物(脂質-ROS)的積累,并導致細胞致命性損害。最近的研究已經確定鐵死亡在介導腫瘤的發展和耐藥性在某些類型的癌癥中的重要作用,但其具體分子機制仍然知之甚少。今年2月,來自天津醫科大學的研究團隊在Molecular Cancer上發表了一篇題名為:CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer的文章。該文章主要講述了CAF通過靶向ALOX15并阻斷脂質ROS的積累,分泌外泌體miR-522來抑制癌細胞的鐵死亡。包括USP7,hnRNPA1,exo-miR-522和ALOX15在內的細胞間途徑揭示了胃癌(GC)獲得化療耐藥性的新機制。

結 果:
1.GC中與鐵死亡相關的關鍵基因的篩選
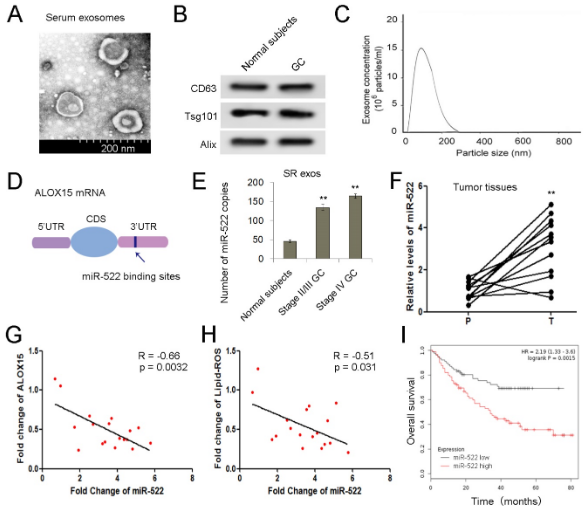
首先使用質譜比較GC特異性蛋白,與癌旁組織(P)相比,一組蛋白在GC腫瘤組織(T)中明顯失調。 ALOX15是導致ferroptosis的關鍵基因之一,顯示出急劇下降,而腫瘤組織中USP7和hnRNPA1的水平明顯升高。隨后,在12例胃癌患者中通過WB和RT-qPCR分析測量ALOX15蛋白和mRNA表達ALXO15蛋白總體呈下降趨勢,但ALOX15 mRNA沒有明顯變化。因此,ALOX15主要在轉錄后水平受GC細胞的調節。通過IHC分析檢查了ALOX15的分布,并且ALOX15主要在癌旁組織的腺細胞中表達,并在腺瘤細胞中少量表達。根據ALOX15蛋白水平的平均值,將GC患者分為ALOX15高組(n = 77)和ALOX15低組(n = 86)。 高水平的ALOX15蛋白還與胃癌患者更好的總體生存率(OS)相關,這表明ALOX15可以作為GC中的一種抗癌因子。由于脂質ROS是ALOX15產生的重要代謝產物,因此,腫瘤組織中的脂質ROS水平明顯降低(圖與ALOX15正相關。這些數據表明,ALOX15在介導胃腫瘤中脂質-ROS產生中起關鍵作用。
通過超速離心分離正常受試者和GC患者的血清外泌體,經鑒定具有外泌體特征。由于在ALOX15蛋白和ALOX15 mRNA之間未發現明顯的相關性,推斷ALOX15在轉錄后水平受miRNA調控。預測miR-522與ALOX15 mRNA相互作用。據報道,miR-522促進非小細胞肺癌,結腸直腸癌和肝細胞癌的腫瘤進展,但尚未明確miR-522在胃癌中的作用。我們的數據顯示,GC患者的血清外泌體和腫瘤組織中的miR-522均上調,并且exo-miR-522與腫瘤等級呈正相關。 此外,發現miR-522與ALOX5表達以及脂質ROS負相關。根據miR-522的平均值,將GC患者分為miR-522高組(n = 184)和miR-522低組(n = 162)。生存曲線是從在線數據庫生成的,并且高水平的miR-522預測GC的存活率很差。 因此,這些結果表明miR-522,ALOX15和脂質-ROS積累之間潛在的臨床相關性。
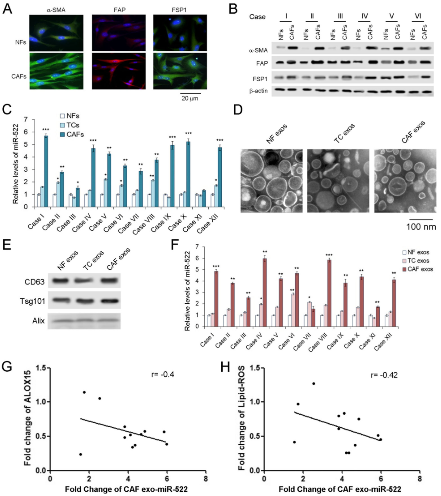
盡管證明外泌體miR-522在GC中明顯上調,但miR-522的起源仍不清楚。分離腫瘤組織中的CAFs和癌旁組織中的正常成纖維細胞(NFs),并在原代細胞和外泌體中測量miR-522的水平。CAF中的標記α-SMA,FAP和FSP1表達量明顯高于NF。GC細胞的標志物CEA和CK-18在NF和CAF中不表達,腫瘤細胞不表達α-SMA,FAP和FSP1。CAF 在三種細胞中miR-522表達最高,提取外泌體并鑒定,CAF外泌體中miR-522的含量在這三種外泌體中占主導地位。不出所料,源自CAF的外泌體miR-522也顯示與ALOX15和脂質ROS呈負相關。這些數據表明,GC腫瘤微環境中的exo-miR-522主要由CAF分泌。
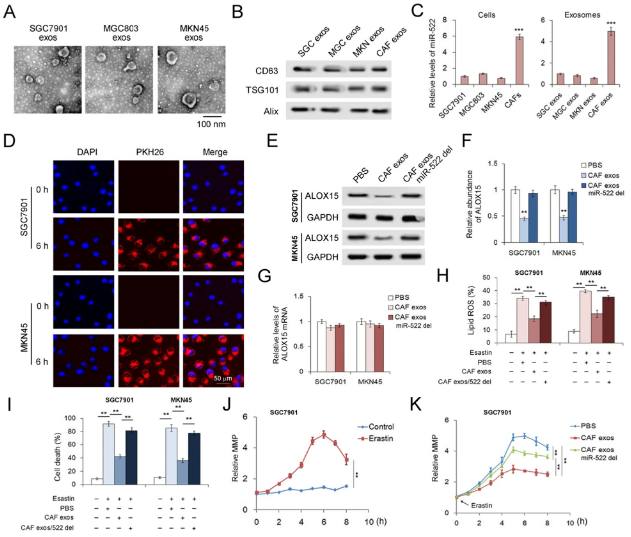
為了測試源自CAF的exo-miR-522在調節癌細胞的肥大性中的功能,分離了CAF外泌體并與人胃癌細胞系共培養。CAF中miR-522的量是GC細胞系的6倍,外泌體中也觀察到了相同的趨勢。將CAF外泌體與GC細胞共培養,并在6 h時在SGC7901細胞和MKN45細胞中均檢測到PKH-26標記的CAF外泌體,表明CAF衍生的外泌體可以與GC細胞有效融合。CAF外泌體miR-522可顯著抑制GC細胞中ALOX15的表達,而不會影響ALOX15 mRNA的含量。此外,已證明exo-miR-522可有效抑制GC細胞中蛋白激酶誘導的脂質ROS積累和鐵死亡。 經過Eaststin處理的SGC7901細胞顯示出明顯的線粒體膜電位(MMP)升高,并且CAF外泌體部分逆轉了Eaststin對線粒體的損傷。總而言之,CAF分泌的exo-miR-522抑制了ALOX15的表達并下調了GC細胞中鐵死亡的水平。
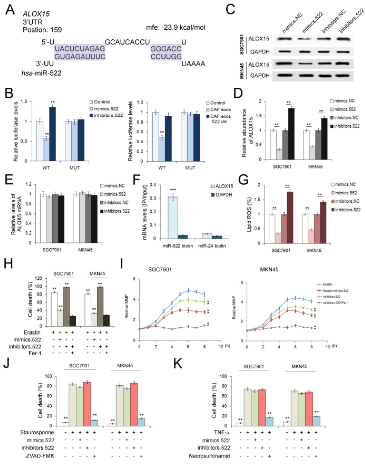
預測將三種miRNA,miR-522,miR-106a和miR-125b作為ALOX15的上游調節子,但是,miR-106a和miR-125b在CAF和NF之間顯示出很小的差異。因此,選擇了miR-522作為ALOX15的潛在調節劑。隨后,進行熒光素酶報告基因檢測,進一步揭示了miR-522和ALOX15 mRNA的直接接觸。構建了含有miR-522結合區的熒光素酶報告質粒,并將含有miR-522結合位點(mut)的反向序列的質粒用作陰性對照。miR-522模擬物的轉染或CAF外泌體的治療會導致螢光素酶活性的顯著抑制。而敲除miR-522則相對增加了螢光素酶的水平。過表達的miR-522顯著降低了ALOX15的水平,而轉染miR-522抑制劑促進了SGC7901和MKN45細胞中ALOX15的表達。但是在miR-522處理下ALOX15的mRNA幾乎沒有變化,這表明miR-522在轉錄后水平上負調控ALOX15的表達。在SGC7901細胞中使用生物素標記的miR-522進行免疫沉淀,并將生物素miR-24用作陰性對照。僅在生物素標記的miR-522組中檢測到ALOX15 mRNA。不出所料,miR-522的過度表達與CAF外泌體在阻斷脂質ROS的積累,抑制蛋白激酶誘導的細胞死亡和逆轉蛋白激酶誘導的MMP升高方面具有相同的作用。抑制劑對miR-522的抑制作用顯示出完全相反的功能。 為了研究miR-522是否與其他類型的細胞死亡有關,我們分別用凋亡激活劑(stauroporine)和抑制劑(ZVAD-FMK),壞死激活劑(TNF-α)和抑制劑(necrosulfonamid)處理了GC細胞。stauroporine和TNF-α均導致GC細胞的細胞死亡顯著增加,但是miR-522無法降低細胞死亡的比例。因此,miR-522通過直接靶向GC細胞中的ALOX15有效地抑制了脂質ROS的產生和鐵死亡。
據報道,hnRNP家族是將一系列mRNA和非編碼RNA包裝到外泌體中所必需的。在當前研究中,hnRNPA1已被MS篩選出其在胃腫瘤組織中的上調作用。IHC分析顯示了USP7,hnRNPA1和ALOX15之間的相關性。接下來,我們檢查了從上述12種腫瘤組織分離出的原發性CAF中hnRNPA1和USP7在中高表達。此外,hnRNPA1和USP7的水平都與外泌體miR-522正相關,這暗示USP7和hnRNPA1參與了CAFs的miR-522分泌。 有趣的是,與去泛素化相關的USP7似乎在增加hnRNPA1水平方面起著重要作用。
為了進一步研究USP7,hnRNPA1和miR-522之間的內部聯系,構建了包含hnRNPA1或USP7編碼序列以及這兩個基因的siRNA的質粒。質粒的轉染顯著上調了hnRNPA1和USP7的表達,而siRNA的應用導致這兩個基因的急劇減少。 hnRNPA1或USP7在CAFs中的過表達促進了miR-522向外泌體的包裝。 然而,兩個基因的敲除相對降低了exo-miR-522的水平。回復實驗表明,過度表達的hnRNPA1或USP7部分抵消了各自siRNA對exo-miR-522的作用。接下來,可以使用抗hnRNPA1抗體在免疫沉淀測定的產物中檢測到USP7,反之亦然。此外,USP7還顯示與hnRNA1泛素化水平呈負相關。總體而言,這些結果表明,USP7通過去泛素化作用使CAF中的hnRNPA1穩定下來,導致外泌體miR-522的分泌增加。
為了進一步驗證hnRNPA1在將miR-522選擇性包裝入外泌體中的作用,使用RBPDB預測了潛在的miR-522結合蛋白。我們還為PABPC1和ACO1設計了siRNA,并且PABPC1和ACO1都明顯被siRNA抑制。這些siRNA的轉染對CAF中miR-522的表達影響很小,是hnRNPA1而不是PABPC1和ACO1的下調顯著降低了CAF外泌體中miR-522的水平。用生物素標記野生型和突變的miR-522,并將其轉染到CAF中,然后進行免疫沉淀。結果表明,使用野生型生物素-miR-522在co-IP生產中僅檢測到hnRNPA1。通過使用0.4μm的聚酯膜共培養原代CAF和SGC7901細胞。簡而言之,將Cy3標記的miR-522轉染到CAF中,并且來自CAF的外泌體通過膜與較低的GC細胞融合。在SGC7901細胞和MKN45細胞中都可以清楚地檢測到Cys-miR-522,并且CAF中hnRNPA1的沉默可阻止cys-miR-522從CAF轉移至GC細胞。因此,這些數據提供了直接的證據,表明hnRNPA1在介導miR-522到CAF外泌體的包裝中起著重要的作用。
為了獲得CAF中由化療引起的損傷反應,我們檢查了用亞致死劑量的順鉑或紫杉醇處理過的GC細胞。順鉑和紫杉醇對CAFs細胞活力的抑制作用。,順鉑或紫杉醇均能促進CAF中USP7和hnRNPA1的表達;藥物毒性還增強了hnRNPA1的去泛素化作用。該結果表明,化療誘導的損傷可通過增加USP7的表達并減少hnRNPA1的泛素化來促進miR-522包裝入外泌體。將從順鉑(Cis-CAF外泌體)或紫杉醇(Pac-CAF外泌體)處理的CAF中分離出的外泌體與GC細胞共培養,它們顯示出比對照CAF外泌體更大的抑制ALOX15蛋白表達的能力,而不會影響ALOX15轉錄。Cis-CAF外泌體和Pac-CAF外泌體在SGC7901細胞和MKN45細胞中均能更有效地減少脂質ROS的產生,并抑制蛋白抑制素引起的肥大癥。在培養基中添加順鉑極大地導致了GC細胞的高死亡率,而順式CAF外泌體和Pac-CAF外泌體則降低了死亡率。這些體外實驗提供了證據,證明CAF外泌體有助于降低化療期間的藥物敏感性。
最后,在體內評估了USP7 / hnRNPA1 / miR-522軸在影響腫瘤生長和化學治療功效中的作用。通過使用shRNA的慢病毒,分別產生了USP7,hnRNPA1和miR-522敲低的三種胃CAF株,并將這些胞株與SGC7901細胞混合用于小鼠皮下腫瘤植入。從第10天起每5天向這些荷瘤小鼠注入順鉑(5μg/ g)或生理鹽水,并在第30天收獲腫瘤。在CAF中敲除USP7,hnRNPA1或miR-522可明顯抑制腫瘤生長并增強對順鉑的敏感性,但上調了脂質ROS的水平。敲除USP7會降低hnRNPA1蛋白質水平。而CAF中三個基因的抑制都會導致癌細胞中ALOX15的上調。進行了使用抗α-SMA抗體的IHC分析,顯示慢病毒轉導不會影響CAF在體內的增殖。順鉑的處理相對促進了CAFs中USP7 / hnRNPA1以及癌細胞中ALOX15的表達,但ALOX15的mRNA幾乎沒有變化。從這些小鼠中分離出血漿外泌體,外泌體miR-522的水平在USP7-KD和hnRNPA1-KD組中急劇下降,在miR-522-KD組中最低。鐵死亡標志物PYGS2明顯上調,而凋亡的標志物CASP3隨著CAF中USP7,hnRNPA1和miR-522的敲低而略有增加。
USP7,hnRNPA1和miR-522的表達受抑制延長了荷瘤小鼠的生存期,順鉑組的小鼠比用鹽水治療的小鼠具有更好的生存期。
該研究闡明了TME衍生的外泌體通過轉運特殊的信號傳遞信息在調節癌細胞的鐵死亡中的新作用。這項研究還提供了一種新的想法,即通過阻止特定的miRNA包裝到外泌體中來觸發腫瘤中的細胞死亡。
1.GC中與鐵死亡相關的關鍵基因的篩選
首先使用質譜比較GC特異性蛋白,與癌旁組織(P)相比,一組蛋白在GC腫瘤組織(T)中明顯失調。 ALOX15是導致ferroptosis的關鍵基因之一,顯示出急劇下降,而腫瘤組織中USP7和hnRNPA1的水平明顯升高。隨后,在12例胃癌患者中通過WB和RT-qPCR分析測量ALOX15蛋白和mRNA表達ALXO15蛋白總體呈下降趨勢,但ALOX15 mRNA沒有明顯變化。因此,ALOX15主要在轉錄后水平受GC細胞的調節。通過IHC分析檢查了ALOX15的分布,并且ALOX15主要在癌旁組織的腺細胞中表達,并在腺瘤細胞中少量表達。根據ALOX15蛋白水平的平均值,將GC患者分為ALOX15高組(n = 77)和ALOX15低組(n = 86)。 高水平的ALOX15蛋白還與胃癌患者更好的總體生存率(OS)相關,這表明ALOX15可以作為GC中的一種抗癌因子。由于脂質ROS是ALOX15產生的重要代謝產物,因此,腫瘤組織中的脂質ROS水平明顯降低(圖與ALOX15正相關。這些數據表明,ALOX15在介導胃腫瘤中脂質-ROS產生中起關鍵作用。

通過超速離心分離正常受試者和GC患者的血清外泌體,經鑒定具有外泌體特征。由于在ALOX15蛋白和ALOX15 mRNA之間未發現明顯的相關性,推斷ALOX15在轉錄后水平受miRNA調控。預測miR-522與ALOX15 mRNA相互作用。據報道,miR-522促進非小細胞肺癌,結腸直腸癌和肝細胞癌的腫瘤進展,但尚未明確miR-522在胃癌中的作用。我們的數據顯示,GC患者的血清外泌體和腫瘤組織中的miR-522均上調,并且exo-miR-522與腫瘤等級呈正相關。 此外,發現miR-522與ALOX5表達以及脂質ROS負相關。根據miR-522的平均值,將GC患者分為miR-522高組(n = 184)和miR-522低組(n = 162)。生存曲線是從在線數據庫生成的,并且高水平的miR-522預測GC的存活率很差。 因此,這些結果表明miR-522,ALOX15和脂質-ROS積累之間潛在的臨床相關性。
盡管證明外泌體miR-522在GC中明顯上調,但miR-522的起源仍不清楚。分離腫瘤組織中的CAFs和癌旁組織中的正常成纖維細胞(NFs),并在原代細胞和外泌體中測量miR-522的水平。CAF中的標記α-SMA,FAP和FSP1表達量明顯高于NF。GC細胞的標志物CEA和CK-18在NF和CAF中不表達,腫瘤細胞不表達α-SMA,FAP和FSP1。CAF 在三種細胞中miR-522表達最高,提取外泌體并鑒定,CAF外泌體中miR-522的含量在這三種外泌體中占主導地位。不出所料,源自CAF的外泌體miR-522也顯示與ALOX15和脂質ROS呈負相關。這些數據表明,GC腫瘤微環境中的exo-miR-522主要由CAF分泌。
為了測試源自CAF的exo-miR-522在調節癌細胞的肥大性中的功能,分離了CAF外泌體并與人胃癌細胞系共培養。CAF中miR-522的量是GC細胞系的6倍,外泌體中也觀察到了相同的趨勢。將CAF外泌體與GC細胞共培養,并在6 h時在SGC7901細胞和MKN45細胞中均檢測到PKH-26標記的CAF外泌體,表明CAF衍生的外泌體可以與GC細胞有效融合。CAF外泌體miR-522可顯著抑制GC細胞中ALOX15的表達,而不會影響ALOX15 mRNA的含量。此外,已證明exo-miR-522可有效抑制GC細胞中蛋白激酶誘導的脂質ROS積累和鐵死亡。 經過Eaststin處理的SGC7901細胞顯示出明顯的線粒體膜電位(MMP)升高,并且CAF外泌體部分逆轉了Eaststin對線粒體的損傷。總而言之,CAF分泌的exo-miR-522抑制了ALOX15的表達并下調了GC細胞中鐵死亡的水平。
預測將三種miRNA,miR-522,miR-106a和miR-125b作為ALOX15的上游調節子,但是,miR-106a和miR-125b在CAF和NF之間顯示出很小的差異。因此,選擇了miR-522作為ALOX15的潛在調節劑。隨后,進行熒光素酶報告基因檢測,進一步揭示了miR-522和ALOX15 mRNA的直接接觸。構建了含有miR-522結合區的熒光素酶報告質粒,并將含有miR-522結合位點(mut)的反向序列的質粒用作陰性對照。miR-522模擬物的轉染或CAF外泌體的治療會導致螢光素酶活性的顯著抑制。而敲除miR-522則相對增加了螢光素酶的水平。過表達的miR-522顯著降低了ALOX15的水平,而轉染miR-522抑制劑促進了SGC7901和MKN45細胞中ALOX15的表達。但是在miR-522處理下ALOX15的mRNA幾乎沒有變化,這表明miR-522在轉錄后水平上負調控ALOX15的表達。在SGC7901細胞中使用生物素標記的miR-522進行免疫沉淀,并將生物素miR-24用作陰性對照。僅在生物素標記的miR-522組中檢測到ALOX15 mRNA。不出所料,miR-522的過度表達與CAF外泌體在阻斷脂質ROS的積累,抑制蛋白激酶誘導的細胞死亡和逆轉蛋白激酶誘導的MMP升高方面具有相同的作用。抑制劑對miR-522的抑制作用顯示出完全相反的功能。 為了研究miR-522是否與其他類型的細胞死亡有關,我們分別用凋亡激活劑(stauroporine)和抑制劑(ZVAD-FMK),壞死激活劑(TNF-α)和抑制劑(necrosulfonamid)處理了GC細胞。stauroporine和TNF-α均導致GC細胞的細胞死亡顯著增加,但是miR-522無法降低細胞死亡的比例。因此,miR-522通過直接靶向GC細胞中的ALOX15有效地抑制了脂質ROS的產生和鐵死亡。
據報道,hnRNP家族是將一系列mRNA和非編碼RNA包裝到外泌體中所必需的。在當前研究中,hnRNPA1已被MS篩選出其在胃腫瘤組織中的上調作用。IHC分析顯示了USP7,hnRNPA1和ALOX15之間的相關性。接下來,我們檢查了從上述12種腫瘤組織分離出的原發性CAF中hnRNPA1和USP7在中高表達。此外,hnRNPA1和USP7的水平都與外泌體miR-522正相關,這暗示USP7和hnRNPA1參與了CAFs的miR-522分泌。 有趣的是,與去泛素化相關的USP7似乎在增加hnRNPA1水平方面起著重要作用。
為了進一步研究USP7,hnRNPA1和miR-522之間的內部聯系,構建了包含hnRNPA1或USP7編碼序列以及這兩個基因的siRNA的質粒。質粒的轉染顯著上調了hnRNPA1和USP7的表達,而siRNA的應用導致這兩個基因的急劇減少。 hnRNPA1或USP7在CAFs中的過表達促進了miR-522向外泌體的包裝。 然而,兩個基因的敲除相對降低了exo-miR-522的水平。回復實驗表明,過度表達的hnRNPA1或USP7部分抵消了各自siRNA對exo-miR-522的作用。接下來,可以使用抗hnRNPA1抗體在免疫沉淀測定的產物中檢測到USP7,反之亦然。此外,USP7還顯示與hnRNA1泛素化水平呈負相關。總體而言,這些結果表明,USP7通過去泛素化作用使CAF中的hnRNPA1穩定下來,導致外泌體miR-522的分泌增加。

為了進一步驗證hnRNPA1在將miR-522選擇性包裝入外泌體中的作用,使用RBPDB預測了潛在的miR-522結合蛋白。我們還為PABPC1和ACO1設計了siRNA,并且PABPC1和ACO1都明顯被siRNA抑制。這些siRNA的轉染對CAF中miR-522的表達影響很小,是hnRNPA1而不是PABPC1和ACO1的下調顯著降低了CAF外泌體中miR-522的水平。用生物素標記野生型和突變的miR-522,并將其轉染到CAF中,然后進行免疫沉淀。結果表明,使用野生型生物素-miR-522在co-IP生產中僅檢測到hnRNPA1。通過使用0.4μm的聚酯膜共培養原代CAF和SGC7901細胞。簡而言之,將Cy3標記的miR-522轉染到CAF中,并且來自CAF的外泌體通過膜與較低的GC細胞融合。在SGC7901細胞和MKN45細胞中都可以清楚地檢測到Cys-miR-522,并且CAF中hnRNPA1的沉默可阻止cys-miR-522從CAF轉移至GC細胞。因此,這些數據提供了直接的證據,表明hnRNPA1在介導miR-522到CAF外泌體的包裝中起著重要的作用。

為了獲得CAF中由化療引起的損傷反應,我們檢查了用亞致死劑量的順鉑或紫杉醇處理過的GC細胞。順鉑和紫杉醇對CAFs細胞活力的抑制作用。,順鉑或紫杉醇均能促進CAF中USP7和hnRNPA1的表達;藥物毒性還增強了hnRNPA1的去泛素化作用。該結果表明,化療誘導的損傷可通過增加USP7的表達并減少hnRNPA1的泛素化來促進miR-522包裝入外泌體。將從順鉑(Cis-CAF外泌體)或紫杉醇(Pac-CAF外泌體)處理的CAF中分離出的外泌體與GC細胞共培養,它們顯示出比對照CAF外泌體更大的抑制ALOX15蛋白表達的能力,而不會影響ALOX15轉錄。Cis-CAF外泌體和Pac-CAF外泌體在SGC7901細胞和MKN45細胞中均能更有效地減少脂質ROS的產生,并抑制蛋白抑制素引起的肥大癥。在培養基中添加順鉑極大地導致了GC細胞的高死亡率,而順式CAF外泌體和Pac-CAF外泌體則降低了死亡率。這些體外實驗提供了證據,證明CAF外泌體有助于降低化療期間的藥物敏感性。

最后,在體內評估了USP7 / hnRNPA1 / miR-522軸在影響腫瘤生長和化學治療功效中的作用。通過使用shRNA的慢病毒,分別產生了USP7,hnRNPA1和miR-522敲低的三種胃CAF株,并將這些胞株與SGC7901細胞混合用于小鼠皮下腫瘤植入。從第10天起每5天向這些荷瘤小鼠注入順鉑(5μg/ g)或生理鹽水,并在第30天收獲腫瘤。在CAF中敲除USP7,hnRNPA1或miR-522可明顯抑制腫瘤生長并增強對順鉑的敏感性,但上調了脂質ROS的水平。敲除USP7會降低hnRNPA1蛋白質水平。而CAF中三個基因的抑制都會導致癌細胞中ALOX15的上調。進行了使用抗α-SMA抗體的IHC分析,顯示慢病毒轉導不會影響CAF在體內的增殖。順鉑的處理相對促進了CAFs中USP7 / hnRNPA1以及癌細胞中ALOX15的表達,但ALOX15的mRNA幾乎沒有變化。從這些小鼠中分離出血漿外泌體,外泌體miR-522的水平在USP7-KD和hnRNPA1-KD組中急劇下降,在miR-522-KD組中最低。鐵死亡標志物PYGS2明顯上調,而凋亡的標志物CASP3隨著CAF中USP7,hnRNPA1和miR-522的敲低而略有增加。
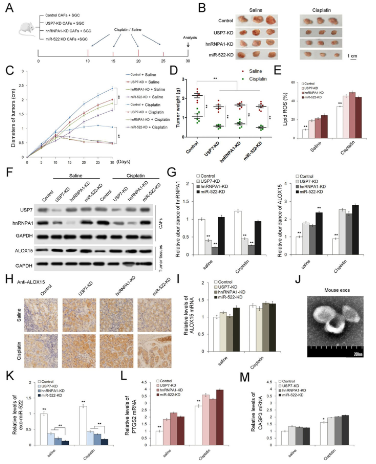
USP7,hnRNPA1和miR-522的表達受抑制延長了荷瘤小鼠的生存期,順鉑組的小鼠比用鹽水治療的小鼠具有更好的生存期。
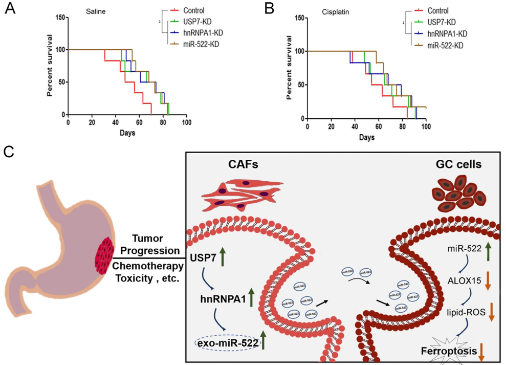
該研究闡明了TME衍生的外泌體通過轉運特殊的信號傳遞信息在調節癌細胞的鐵死亡中的新作用。這項研究還提供了一種新的想法,即通過阻止特定的miRNA包裝到外泌體中來觸發腫瘤中的細胞死亡。
上一篇:
外泌體、tRF研究解決方案與免費課題設計
下一篇:
外泌體circRNA參與腫瘤免疫治療






