外泌體是如何作為納米治療劑的?
該研究是2019年8月發表于Theranostics的文章‘Mesenchymal stem cell-derived exosomes as a nanotherapeutic agent for amelioration of inflammation-induced astrocyte alterations in mice’(IF=8.063)。間充質干細胞衍生的外泌體在治療癲癇、中風或創傷性腦損傷等神經系統疾病中具有強大的抗炎作用。雖然星形膠質細胞被認為是這些效應的介質,但對它們的作用仍知之甚少。為了解決這個問題,該實驗研究了骨髓MSC-Exo對炎癥誘導的星形膠質細胞改變的治療作用和機制。
文章縮寫:
間充質干細胞外泌體(MSC-Exo)
脂多糖(LPS)
細胞增殖標記(ki67)
一種反應性星形膠質增生標記(GFAP)
假手術(Sham)
硒(SE)
結果:
一 、骨髓間充質干細胞(MSC)和外泌體(Exo)的特征
根據流式細胞儀分析,Wharton’s Jelly組織的酶消化獲得的MSC的CD73,CD90和CD105呈陽性,而造血譜系標記(如CD34和CD45)呈陰性,且顯示出分化為脂肪細胞,骨細胞和軟骨細胞譜系的潛力。通過一系列超速離心產生的MSC-Exo,對經典的外泌體標記物呈陽性(圖1A)。當通過TEM和納米粒子跟蹤分析檢查MSC-Exo的形態和粒徑時,結果顯示出MSC外泌體的經典“杯狀邊緣”形態(圖1B),并且絕大多數源自MSC的外泌體具有預期直徑為30至150 nm(圖1C)。結果表明,實驗中MSC-Exo的特征符合外泌體的典型標準。
二、星形膠質細胞的特征及骨髓MSC-Exo摻入
GFAP/Iba1雙重免疫染色檢查培養的星形膠質細胞的組成(圖1D)。 92.16%的細胞表達了GFAP,只有2.99%的細胞顯示了Iba1+免疫染色(圖1E)。為了在體外和體內追蹤MSC-Exo,星形膠質細胞和SE模型的原代培養接受了CM-A594標記的外泌體,并通過GFAP(圖1F)或s100-β(圖1G)檢查了細胞或組織樣品染色。紅色的MSC-Exo納米顆粒似乎呈較小的簇狀,在星形膠質細胞的整個原代培養物中(圖1F1)以及在小鼠的海馬星形膠質細胞中觀察到(圖1G1)。在細胞樣本和海馬中,外泌體攝取的熒光強度分別為0.9885±0.1844和0.2812±0.03721。結果表明,MSC-Exo可以在體外和體內摻入海馬星形膠質細胞。
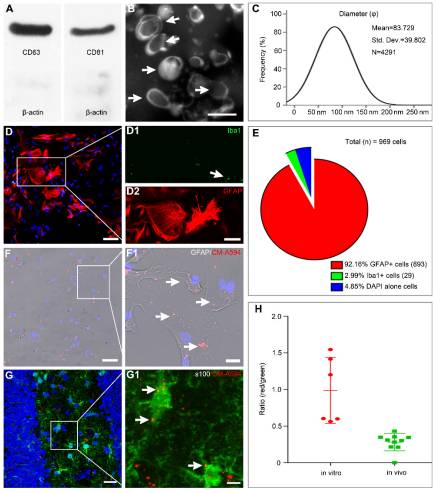
圖1.MSC-Exo和星形膠質細胞表征,納米粒子追蹤。
三、骨髓MSC-Exo治療可減輕脂多糖(LPS)誘導的細胞毒性、反應性星形膠質細胞增生和炎癥反應在體內
免疫熒光實驗(圖2A-L)表明,與LPS組相比,MSC-Exo處理極顯著降低了GFAP(一種反應性星形膠質增生標記)的相對表達(圖2M),C3(A1星形膠質細胞標記,圖2N),CD81(星形細胞活化的基本調節劑,圖2O)和ki67(細胞增殖標記,圖2P)。 WB(圖2Q)顯示LPS+GFAP(圖2R),C3(圖2S)和CD81(圖2T)的蛋白表達顯著降低MSC-Exo組與LPS組相比。使用ELISA來檢查MSC-Exo對LPS誘導的星形膠質細胞的抗炎反應。與LPS組相比,MSC-Exo處理顯著減弱了培養基中TNFα(圖2U)和IL-1β(圖2V)的分泌,但并未減弱IL-6(圖2W)。這些結果表明,MSC-Exo可以顯著降低LPS誘導的細胞毒性,反應性星形膠質細胞增生和炎癥反應。
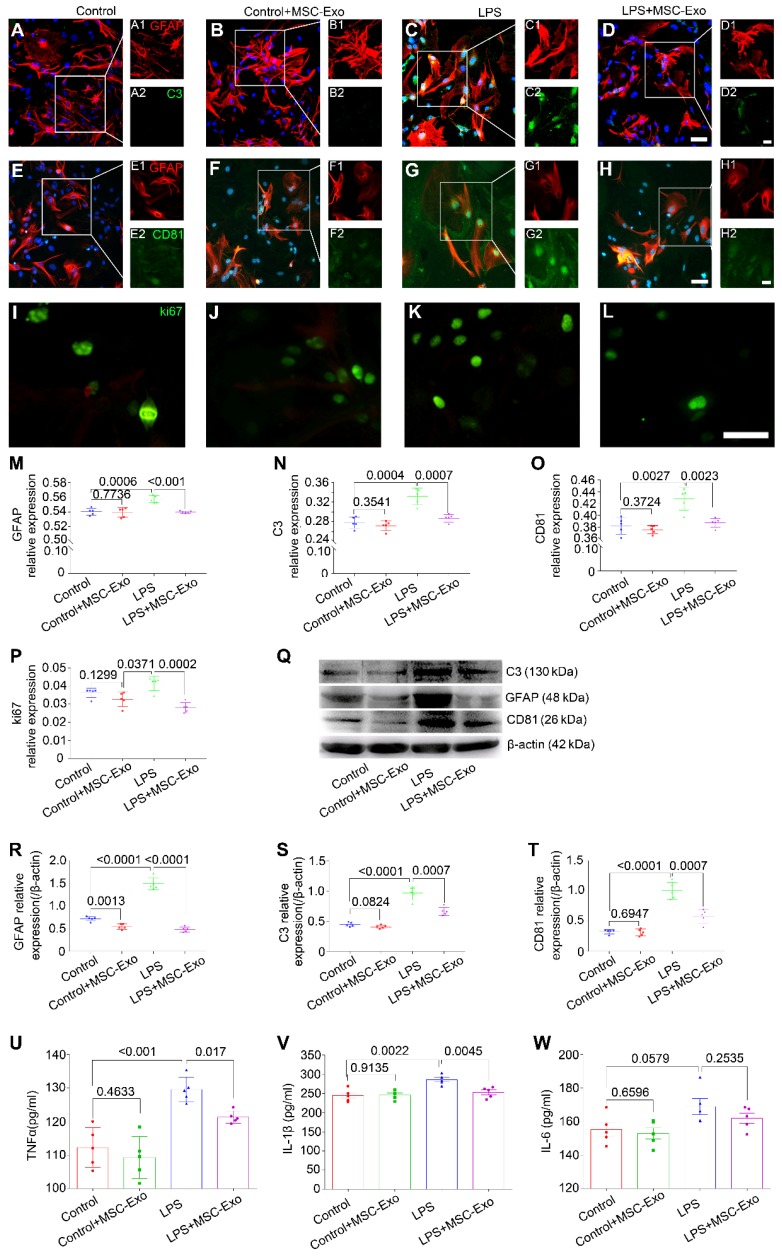
圖2.骨髓間充質干細胞-Exo對LPS誘導的星形膠質細胞活化和炎癥反應的保護作用在體內。
四 、骨髓間充質干細胞外泌體(MSC-Exo)處理改善脂多糖(LPS)誘導的星形膠質細胞原代培養中異常鈣信號和線粒體功能障礙
使用鈣成像研究星形膠質細胞原代培養中鈣信號的改變。星形膠質細胞在各個組中具有不同的熒光特性(圖3A-D)。在ATP刺激后,第一階段Ca2+響應,一個尖峰代表一個瞬時的大幅度增加的細胞內Ca2+組成,第二階段的響應,即對照組中的細胞內Ca2+濃度緩慢下降(圖3E),Control+MSC-Exo(圖3F),LPS(圖3G)和LPS+ MSC-Exo(圖3H)組。統計分析表明,與對照組相比LPS組在添加ATP后具有更高的細胞內Ca2+振蕩幅度(ΔF/ F),而在Control+MSC-Exo組中未檢測到這種變化(圖3I)。 MSC-Exo與LPS組相比,治療(LPS+MSC-Exo)極顯著減少了Ca2+內流(圖3I)。與對照組相比,LPS刺激導致響應時間極顯著上升(圖3J)和衰減時間的變化顯著更快(圖3K)。在Control+MSC-Exo組中無變化(圖3J,圖3K)。MSC-Exo逆轉了LPS組中觀察到的Ca2+振蕩速率(圖3J和K)。由于線粒體通透性對于炎癥誘導的星形細胞活化至關重要,因此使用線粒體特異性親脂性陽離子熒光染料JC-1進一步檢查了原代培養中星形膠質細胞的MMP(圖3L-O)。統計分析表明,LPS組的JC-1比率顯著降低(圖3P),而通過MSC-Exo給藥可以逆轉(圖3P)。在Control組和Control+ MSC-Exo組之間無顯著差異(圖3P)。總之,MSC-Exo可改善海馬星狀細胞原代培養物中LPS誘導的異常鈣信號傳導和線粒體功能障礙。
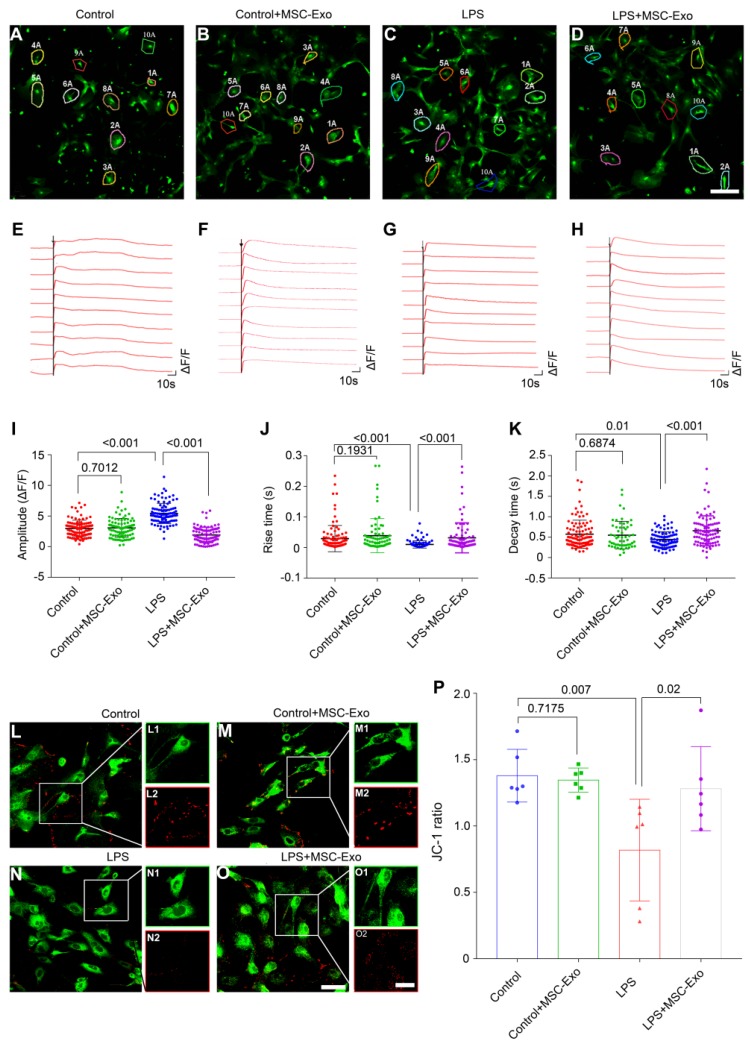
圖3.骨髓MSC-Exo治療改善LPS誘導的海馬星形膠質細胞原代培養中異常鈣信號和線粒體功能障礙。
五、sgRNA敲除Nrf2降低骨髓MSC-Exo對星形膠質細胞活化的抑制作用在體內
免疫印跡和免疫熒光用于探討Nrf2-NF-κB信號通路是否參與了星形膠質細胞活化的抑制。Western印跡法顯示LPS極顯著增加了抗氧化劑(Nrf2,Keap1,HO-1)和炎癥性蛋白(p-P65/P-65,NF-κB激活和炎癥標記)的表達(圖4A),而MSC-Exo治療逆轉了這些變化(圖4D-G)。此外,control+ MSC-Exo組的NF-κB活化極顯著降低(圖4E)。免疫熒光進一步檢查抗氧化劑和炎性因子的核易位,對培養的星形膠質細胞中的LPS刺激,MSC-Exo處理抑制Nrf2和P-65的核易位(圖4B,C)。
為了確定通過MSC-Exo抑制LPS誘導的星形細胞活化的機制,用sgRNA敲除原代培養的星形膠質細胞中的Nrf2基因。 Western印跡法(圖4H)顯示敲低Nrf2(圖4J)顯著降低NF-κB(圖4K),Keap1(圖4L)和HO-1(圖4M)。與sgRNA組相比,LPS刺激極顯著上調了Nrf2,NF-κB和HO-1的表達(圖4J,K),但與sgRNA組相比,并沒有改變Keap1的表達(圖4L)。在LPS誘導的Nrf2敲低星形膠質細胞中,與sgRNA + LPS組相比,MSC-Exo的給藥未影響氧化(Nrf2,Keap1和HO-1)和炎癥(p-P65/P-65和GFAP)的標志物(圖4I-M)。這些數據表明,通過MSC-Exo處理可預防LPS誘導的星形細胞活化,NF-κB-Nrf2信號通路起著決定性作用。

圖4.Nfr2的sgRNA敲除降低了骨髓MSC-Exo對星形膠質細胞活化的抑制作用在體內。
六、側腦室注射骨髓間充質干細胞外泌體(MSC-Exo)可減輕小鼠海馬反應性星形膠質細胞增生
蛋白質印跡法使用毛果蕓香堿誘導的SE模型檢查MSC-Exo的抗反應性星形膠質細胞增生,這是海馬中強烈的反應性星形膠質細胞增生的特征。從假手術(Sham),Sham + Exo,SE + PBS和SE + Exo實驗組中收集海馬組織(圖5Q)。注射PBS的小鼠在術后24、4 d和8 w時C3(圖5R),CD81(圖5S)和GFAP(圖5T)的表達極顯著增加。MSC-Exo處理在SE后4 d和8 w顯著降低了標志物的表達(圖5R-T),但在SE后24 h卻沒有降低(圖5R-T)。SE后4天,使用免疫組織化學進一步檢查了MSC-Exo對反應性星形膠質增生的假定治療作用(圖5A-L)。熒光強度分析顯示,SE + Exo組中GFAP,CD81,C3和ki67的相對表達顯著降低(圖5M-P)與SE + PBS組相比(P <0.01),沒有觀察到MSC-Exo對假手術組動物的不利影響(圖5M-P和R-T)。數據顯示,在SE小鼠模型腦室內注射MSC-Exo可以減少海馬反應性星形膠質細胞增生。
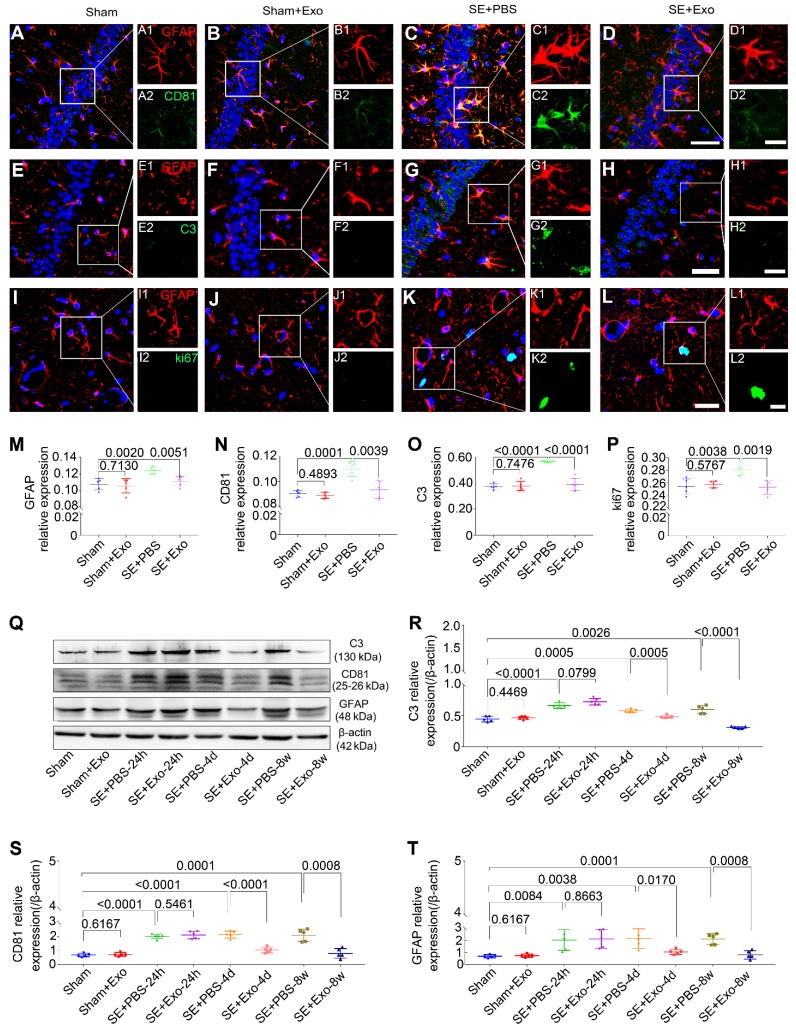
圖5.側腦室注射骨髓間充質干細胞可減輕硒誘導的小鼠海馬星形膠質細胞活化。
七、骨髓MSC-Exo減輕硒(SE)誘導的小鼠海馬炎癥反應
為明確MSC-Exo在SE模型中的抗炎作用,SE后4天收集了雙側海馬組織,并進行了免疫組化、ELISA和qPCR檢測。結果顯示,除了星形膠質細胞外,小膠質細胞還可以分泌炎性細胞因子如TNFα,IL-1β和IL-6(圖6A-L)。雙重免疫染色結果顯示,GFAP與TNFα和IL-1β共表達(圖6A-D),毛果蕓香堿注射后TNFα和IL-1β的熒光強度顯著增加(圖6E-F ),而MSC-Exo處理與SE + PBS組相比降低了它們的表達水平(圖6E-F)。在海馬促炎細胞因子TNFα(圖6G)和IL-1β(圖6H)的濃度下顯著增加,但IL-6顯示增加相比于假手術組(圖5I)。與SE+PBS組相比,MSC-Exo處理顯著降低了促炎細胞因子TNFα(圖6G)和IL-1β(圖6H)的產生。qPCR檢測在海馬中的TNFα,IL-1β和IL-6(圖6J-L)基因表達,結果與假手術組比,毛果蕓香堿治療可極顯著提高海馬TNFα和IL-1β基因的表達(圖6J,K),而MSC-Exo給藥與假手術組相比顯著降低TNFα和IL-1βRNA的水平。 SE +PBS組(圖6J,K)。在qPCR測定的IL-6表達中,假手術和Sham + Exo組之間無差異,這與ELISA結果一致(圖6I,L)。這些數據表明,MSC-Exo可以減輕SE誘導的小鼠海馬炎癥反應。
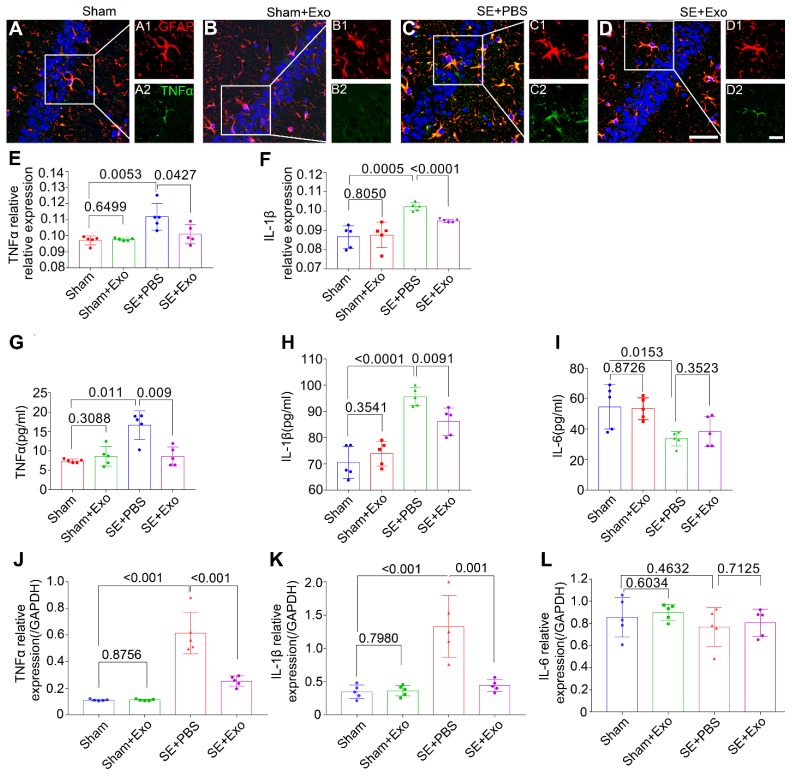
圖6.骨髓MSC-Exo注射減輕了硒誘導的海馬炎癥反應。
八、MSC-Exo處理可通過Nrf2-NF-κB信號傳導通路恢復SE誘導的海馬星形膠質細胞活化
為了研究Nrf2-NF-κB信號通路是否參與星形膠質細胞激活的抑制,免疫印跡和免疫組化用來檢測硒誘導后4 d的海馬組織。毛果蕓香堿處理可顯著增加海馬中GFAP,Nrf2,p-P65/P-65和HO-1的表達,但會降低Keap1的表達(圖7D-E),促進了SE小鼠中Nrf2(圖7B)和P-65(圖7C)的核易位。MSC-Exo處理(SE + Exo組)與PBS(SE + PBS組)的比較顯示,MSC-Exo可以逆轉氧化(圖7B,E和F)和炎癥表型(圖7C,G和H)。無顯著差異Sham+ Exo和假手術組表明,單獨進行MSC-Exo處理不會改變與這些表型相關的標志物的表達(圖7D-H)。
為探索體內抑制星形膠質細胞活化的Nrf2-NF-κB信號通路的機制,使用了Nrf2抑制劑ML385。蛋白質測定法顯示,用ML385處理的小鼠的Keap1,HO-1,Nrf2和p-P65/P-65表達顯著降低(圖7D-H)。盡管這些標記在SE誘導后被極顯著上調(圖7D-F和H),但ML385 + SE + PBS和ML385 + SE + Exo組之間未觀察到顯著差異(圖7D-F和H)。此外,與Sham或Vehicle組相比,Nrf2抑制導致GFAP表達增加(圖7G),而用MSC-Exo處理的ML385 + SE + Exo組則不存在表達差異(圖7G)。結果表明,MSC-Exo處理可以通過Nrf2-NF-κB信號通路恢復LPS和SE誘導的小鼠海馬星形膠質細胞活化。
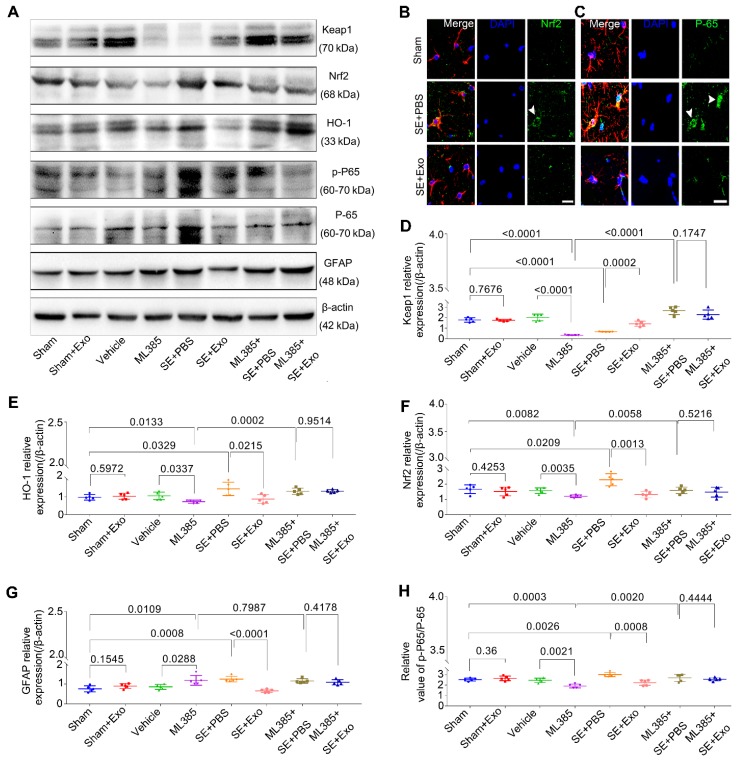
圖7.ML385 (Nrf2抑制劑)注射逆轉骨髓MSC-Exo對海馬星形膠質細胞活化的抑制作用體內。
九、MSC-Exo治療可恢復SE誘導的學習和記憶障礙
莫里斯水迷宮實驗進行了SE誘導的行為效應分析。重復測量的方差分析顯示各組之間的第一次學習時間無差異。在隱藏平臺任務中,與假手術組相比,SE小鼠的逃避潛伏期顯著減少 (圖8A)。給予MSC-Exo可逆轉這種趨勢(圖8A)。24h后,通過記錄在目標象限中花費的時間并計算平臺穿越次數來測試每組中的檢索差異。與假手術組相比,SE小鼠在目標象限(PT)和平臺交叉點中的總游泳距離明顯降低(圖8B和C)。 SE+Exo組的學習和記憶障礙的顯著減少表現為與目標象限(圖8B)和平臺交叉點(圖8C)相比,SE+PBS組花費的時間百分比增加了,兩組之間的游泳速度沒有差異(圖8D)。

圖8.骨髓MSC-Exo治療改善了硒誘導的小鼠學習和記憶障礙。
結 論:
骨髓MSC-Exo改善炎癥誘導的星形膠質細胞改變,并且Nrf2-NF-κB信號通路參與調節小鼠星形膠質細胞的活化。這些數據表明,骨髓MSC-Exo作為納米治療劑在治療海馬星形膠質細胞改變的神經系統疾病方面具有很大的潛力。






