與人類線粒體疾病相關的CO2敏感的tRNA修飾
由Tsutomu Suzuki帶領的日本團隊于2018年5月在Nature Communicatio n雜志(IF=12.35)發的一篇文章:一般認為,tRNAs修飾是穩定和靜態的,并且他們的修飾頻率幾乎不被調控。研究發現,在5個物種的線粒體tRNAs中,N6 –蘇氨酸氨基甲酰腺苷酸(t6A)主要發生在線粒體的第37號位置。這篇文章中發現:YRDC和OSGEPL1是形成t6A37不可或缺的組分,這主要是通過L-蘇氨酸、ATP和CO2/碳酸氫鹽作為底物來實現的。同時,在OSGEPL1基因敲除細胞中發現了呼吸系統缺陷,并且OSGEPL1基因敲除后能夠阻礙線粒體翻譯。在從MERRF樣病人細胞中分離出突變的mt-tRNAs中發現t6A37低表達,這就說明缺乏t6A37會導致疾病的發生。t6A37的動力學表明CO2/碳酸氫鹽的Km值非常高(31mM),這就是說明CO2/碳酸氫鹽是t6A37形成的限速因子。與此一致的是還發現用沒有加入碳酸氫鹽的培養基培養的人細胞中分離的mt-tRNAs中的t6A37也是低表達。這些發現說明t6A37是由傳感細胞內CO2/碳酸氫鹽的濃度調節的。
技術路線:
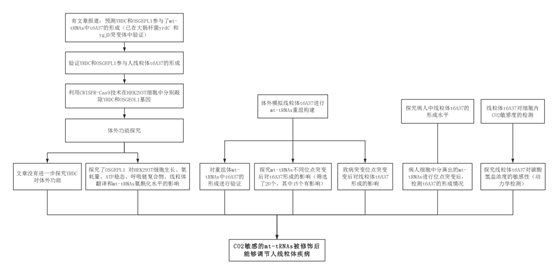
結果:
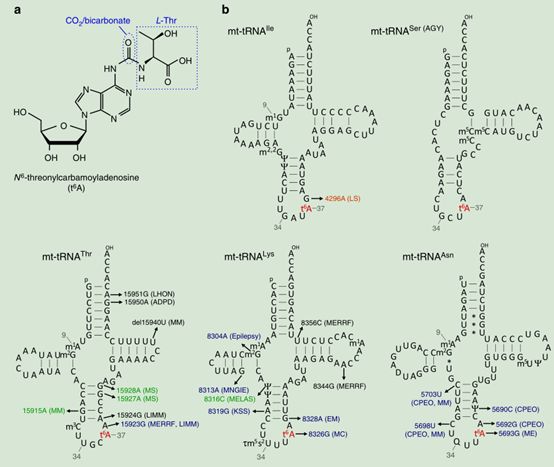
圖1. 人mt-RNAs的t6A。a. tRNAs的化學結構。橢圓虛線代表CO2/碳酸氫鹽,方形虛線代表L-絲氨酸。b. 5個帶有t6A37的人mt-tRNAs的二級結構和轉錄后修飾位點。
1. YRDC參與線粒體t6A37的形成。
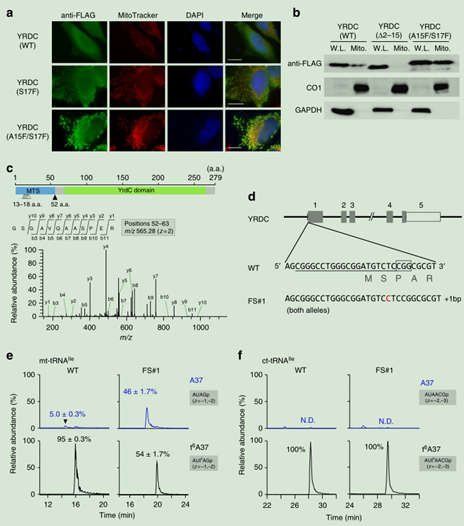
圖2. a. Hela細胞中進行YRDC亞細胞定位,FLAG抗體進行免疫熒光染色。細胞核和染色質分別用DAPI(藍色)和Mito Tracker(紅色)。注:S17F、A15F/S17F (YRDC進行MTS區突變)。 b. WB方法在線粒體中,對YRDC進行定位。注:a.a. Δ2–15(YRDC進行N-末端突變)和A15F/S17F (YRDC進行MTS區突變), CO1(線粒體的marker)、GAPDH(細胞質的marker)。c. 確定YRDC在MTS上的切割位點。上:預測的MTS(藍色)和大腸桿菌相同的保守區域(綠色)代表YRDC。白色和黑色箭頭所指位置分別是Hela細胞中長和短YRDC亞型的多切割位點。中和下:CID光譜代表在52位點上短亞型切割位點的N-末端胰蛋白酶肽序列。CID的前體是m/z565.28。d.利用CRISPR-Cas9系統敲除YRDC基因。人YRDC基因和CRISPR-Cas9系統的插入位點(陰影部分代表編碼區,打開的盒子部分代表外顯子的非轉錄區域,線代表內含子,插入在WT YRDC的1號外顯子)。劃線部分是sgRNA的靶點序列。并產生了MTS突變的細胞系(FS#1)的序列,插入的C用紅色表示。ef. 離子色譜圖(XICs)分析通過從WT、FS#1細胞系分離的mt-tRNAIle和ct-tRNAIle中A37(top)和t6A37(bottom)的表達情況。
2. OSGEPL1參與線粒體t6A37的形成。
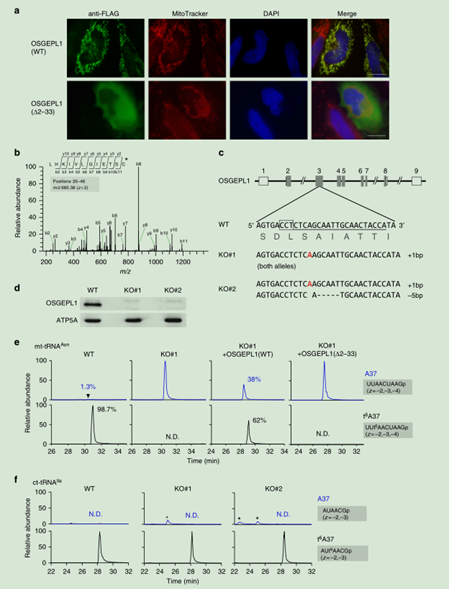
圖3. OSGEPL1參與線粒體t6A37的形成。a. Hela細胞中進行OSGEPL1亞細胞定位,FLAG抗體進行免疫熒光染色。細胞核和染色質分別用DAPI(藍色)和Mito Tracker(紅色)。注:Δ2–33 (OSGEPL1進行MTS突變)。c. 確定OSGEPL1在MTS上的切割位點。CID光譜代表OSGEPL1從35位開始的N-末端多肽的序列。CID的前體是m/z685.38。c. 利用CRISPR-Cas9系統敲除OSGEPL1基因。人OSGEPL1基因和CRISPR-Cas9系統的插入位點(陰影部分代表編碼區,打開的盒子部分代表外顯子的非轉錄區域,線代表內含子,插入在WT OSGEPL1的3號外顯子)。劃線部分是sgRNA的靶點序列。并產生了MTS突變的細胞系(KO#1和KO#2)的序列,插入的A用紅色表示,刪除序列用虛線代表。d. WB檢測OSGEPL1的敲除情況。ATP5A(線粒體marker作為control)。ef. 離子色譜圖(XICs)分析通過從WT、KO#1、加入OSGEPL1的KO#1和加入突變OSGEPL1的 KO#1細胞系分離的mt-tRNAIle和ct-tRNAIle中A37(top)和t6A37(bottom)的表達情況。
3. OSGEPL1缺失導致線粒體功能紊亂。
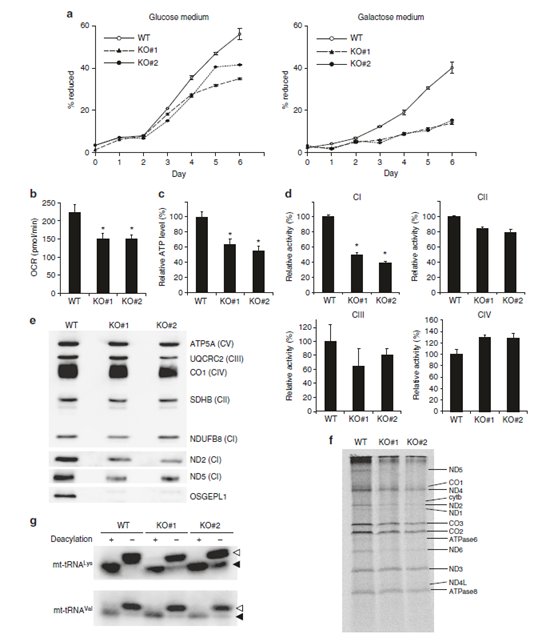
圖4. a. WT, OSGEPL1 KO#1和OSGEPL1 KO#2細胞的生長曲線圖,左:培養基加入葡萄糖作為基礎C源,右:培養基中加入半乳糖培養作為基礎C源。b. 癢耗率(COR)的測定。c. ATP穩態水平的檢測。d. 呼吸鏈復合物I、II、III和IV(CI-IV)的檢測。e. ND2和ND5(CI的亞單位)核NDUFB8(核編碼CI亞單位)的穩態水平。f. 脈沖標記檢測線粒體的翻譯活性。g. 通過northern blot 檢測mt-tRNAsLys中氨酰化水平。
4. 線粒體mt-tRNA的體外重組的鑒定和突變后導致線粒體疾病。
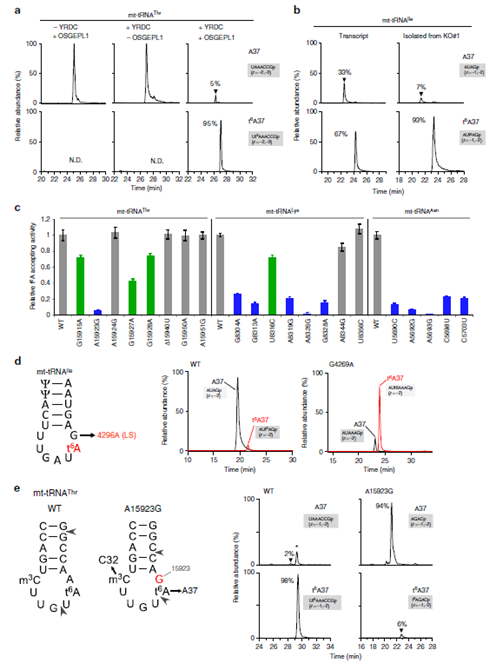
圖5. a. mt-tRNAsThr中轉錄本t6A37體外形成(Thr (95%))(其他mt-tRNAs在補充材料中:Asn (98%)、Lys (95%)、Ile (67%)、Ser(AGY) (34%))。b. 左:mt-tRNAsIle中轉錄本t6A37的形成(Ile (67%));右:來自OSGEPL1-KO的t6A37修飾后。c. Thr, Lys和Asn各位點突變后對mt-tRNAs中t6A37形成的影響。d.mt-tRNAIle致病突變位點G8(G4296A)突變對線粒體t6A37形成的影響。e. 病人細胞中分離出的mt-tRNAThr 進行A15923突變后對線粒體t6A37形成情況。
5. 線粒體t6A37對體內的CO2比較敏感。
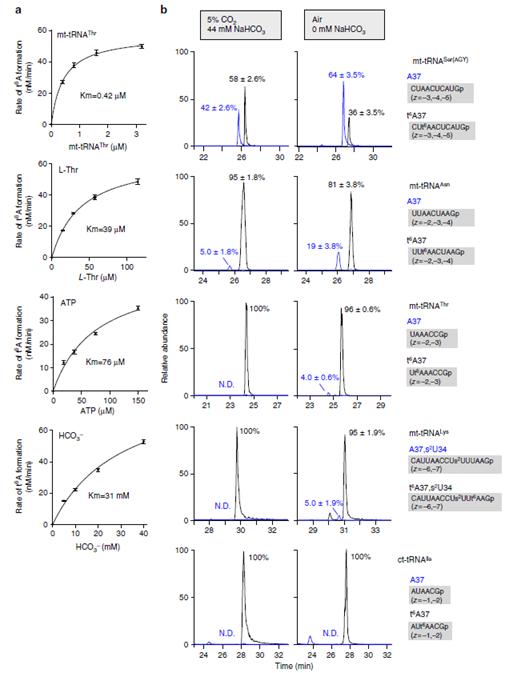
圖6. 線粒體t6A37的形成對細胞內碳酸氫鹽濃度很敏感。a. mt-tRNAThr 中t 6A37形成的動力學檢測。b. 在非碳酸氫鹽培養基培養的HEK293T細胞中t6A37發生修飾的水平。
結論:
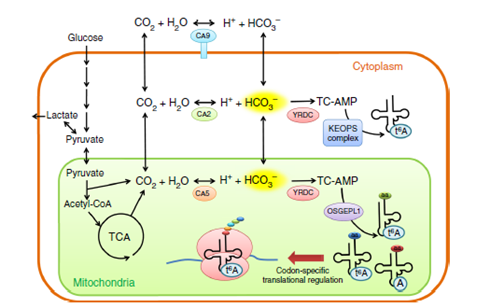
圖7. 在細胞質和線粒體中t6A37的形成和碳酸氫鹽的新陳代謝。線粒體中TCA循環產生的CO2通過碳酸酐酶5(CA5)形成碳酸氫鹽 。此外,線粒體CO2通過碳酸酐酶2(CA2)轉運到細胞質和水里。在低氧條件下, 碳酸酐酶9(CA9)通過HIF-1途徑在細胞表面過度表達。CA9產生大量的細胞外碳酸氫鹽。然后,細胞吸收細胞外碳酸氫鹽,進一步中和乳酸鹽并防止酸化,細胞質中的YRDC復合物和線粒體中的OSGEPL1復合物調節tRNA中t6A37的形成。在沒有碳酸氫鹽培養的條件下,兩個tRNAs中的t6A37處于低修飾水平,跟低氧實體瘤一樣,表明通過傳感細胞內碳酸氫鹽的轉譯調節。
參考文獻:Huan Lin , Kenjyo Miyauchi, Tai Harada, Ryo Okita, Eri Takeshita, Hirofumi Komaki2, Kaoru Fujioka, Hideki Yagasaki, Yu-ichi Goto, Kaori Yanaka, Shinichi Nakagawa, Yuriko Sakaguchi1& Tsutomu Suzuki. CO2-sensitive tRNA modification associated with human mitochondrial disease. Nature communications. (2018) 9:1875.






