S期富集lncRNA的泛癌分析可鑒定致癌因子和生物標志物
盡管近年來的研究使我們對長非編碼RNA (lncRNAs)在癌癥中的作用有了初步的了解,目前還沒有找到與臨床相關的lncRNA。2018年2月末,來自瑞典薩爾格學院的由醫學生物化學和細胞生物學教授Chandrasekhar Kanduri領導的團隊在Nature Communications(IF= 12.353)上發表了題為“PAN-cancer analysis of S-phase enriched lncRNAs identifies oncogenic drivers and biomarkers”的新成果。研究人員通過降低一種特定RNA分子的活性治療患肺癌的小鼠,治愈率達到40%至50%。
該研究提供了一個基于S期相關的lncRNA中具有潛在預后價值的致癌因子或腫瘤標志物的綜合性列表。本文利用新生RNA的捕獲測序技術,鑒定了1145個在S期表達豐富的lncRNAs。其中,通過與TCGA數據庫交叉分析篩選出至少在一種腫瘤類型中表達差異顯著的570個lncRNAs。系統性臨床調查14例泛癌資料,鑒定出了633個新型的的預后標志物。在幾個癌癥模型中,沉默頂層差異表達以及與臨床相關的S期富集lncRNAs(主要檢測了8個)會影響關鍵的癌細胞特征。在多種癌癥類型中對SCAT7的功能與機制研究表明,它與hnRNPK/YBX1復合物相互作用,通過FGF/FGFR及其下游PI3K/AKT和MAPK通路調控腫瘤細胞的標志物。該研究了一種基于LNA反義寡核苷酸的治療癌癥細胞系和患者源性腫瘤(PDX)異種移植的策略。
技術路線:
結果:
1.鑒定跨S期表達的lncRNA 及其在腫瘤中的差異表達
圖1:利用新生RNA捕獲測序鑒定S期表達的lncRNA。a. 新生RNA捕獲在S期的三個不同時間點的細胞周期圖。b. lnRNA的表達譜的主成分分析(PCA)。c.通過STEM聚類分析,S期的lncRNA顯示了四種顯著的時間模式。維恩圖顯示了EtU標記和未標記樣本富集的lncRNA的交叉分析。d. S期富集的lncRNA附近的(< 50kb)蛋白編碼基因分子信號通路分析(左圖)和GO富集分析(右圖)。
2. S期相關的lncRNAs展示出的后生性的變化以及表征為獨立的預后標志物
圖2:使用泛癌TCGA數據集將S期相關的lncRNAs表征為致癌驅動因子和獨立預后標志物。a.在至少一種腫瘤類型中(通過與TCGA數據庫比對)存在顯著差異的表達的S期相關的570個lncRNA。b.維恩圖揭示了S期相關的lncRNA在不同類型的腎癌和肺癌中差異性表達交叉分析。c.抵抗啟動子甲基化相關的S期lncRNA在不同癌癥類型中差異表達狀態。d.熱圖顯示了基于二分法的520個S期lncRNA潛在獨立預后價值。e.維恩圖顯示了s期lncRNA的數量,它們可以獨立地預測不同類型的腎癌和肺癌的生存狀況。
3. SCATs調控細胞周期進程與細胞凋亡
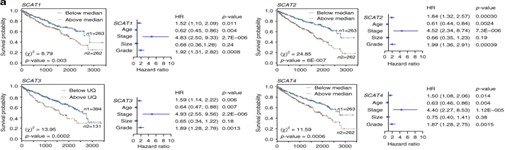
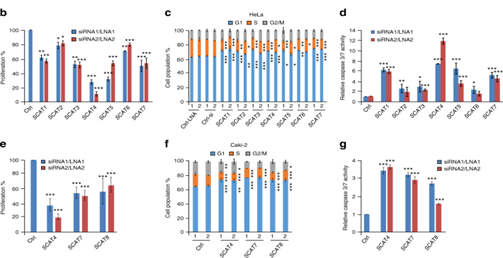
圖3:臨床相關性最高的S期lncRNA調控關鍵的腫瘤標志物。a.SCAT1-SCAT8的Kaplan-Meier圖顯示了KIRC患者的總體生存率。b,c,d.使用兩種不同的LNAs或siRNAs敲低SCATs, SCATs沉默48小時后HeLa細胞的增殖能力,細胞周期以及caspase 3/7活性檢測。e.Caki-2 (KIRC)細胞的MTT分析。f,g.Caki-2細胞用不同的LNAs或siRNA敲低后的細胞周期分布以及caspase 3/7活性。
4. SCAT1和SCAT5分別作為獨立的預后指標
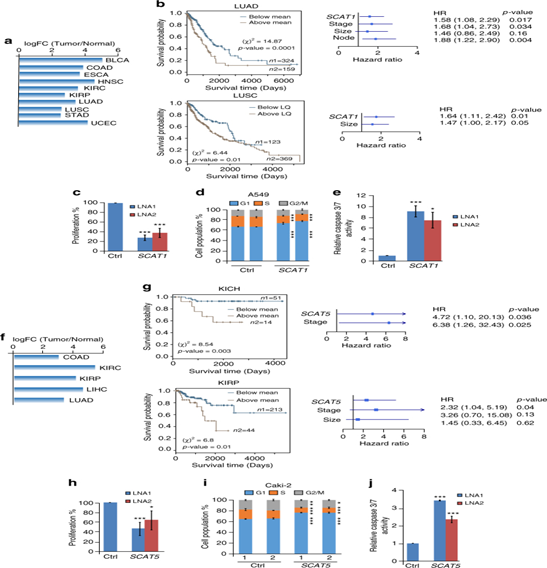
圖4:SCAT1和SCAT5分別作為肺癌和腎源性癌癥的致癌因素和預后指標。a.條形圖顯示了從TCGA數據庫中獲得的10種不同癌癥類型中SCAT1的顯著差異表達水平。b.SCAT1的Kaplan-Meier圖揭示了LUAD和LUSC)型患者的總體生存率。c,d,e.敲低SCAT1的MTT細胞增殖分析,細胞周期狀況以及caspase 3/7活性。f.條形圖顯示了SCAT5在從TCGA數據庫中獲得的5種不同癌癥類型中顯著的差異表達水平。g.SCAT5的Kaplan-Meier圖顯示了KICH和KIRP腎癌患者的總體生存率。h,I,j.對SCAT5沉默的Caki-2細胞系的MTT增殖分析,細胞周期分析以及caspase 3/7的活性。
5. SCAT7調節多種腫瘤細胞的標志物,下調SCAT7的表達誘導細胞衰老
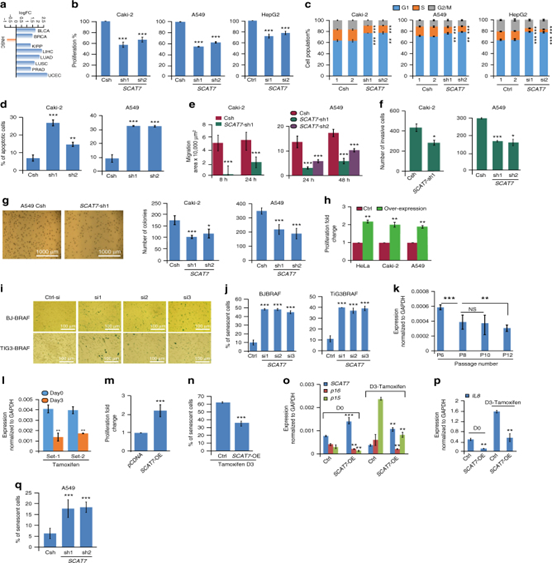
圖5:SCAT7是腎臟、肺和肝癌的致癌因子。a.SCAT7在TCGA數據庫中不同的癌癥類型之間表達呈log2的倍數變化。b,c.敲低SCAT7的 Caki-2, A549,和HepG2細胞的MTT細胞增殖實驗以及細胞的細胞周期分布。d,e,f.g.Caki-2和A549 中SCAT7沉默的48h后凋亡細胞的百分比以及細胞的遷移和Matrigel細胞侵襲實驗以及軟瓊脂克隆形成實驗。h.HeLa, Caki-2和A549細胞過表達SCAT7的MTT細胞增殖實驗。I,j.β-半乳糖苷酶比色檢測使用三種siRNAs沉默72h后。計量衰老細胞占整個細胞群的百分比。k.連續傳代的BJ-BRAF細胞的SCAT7的qPCR。i. SCAT7在其莫西芬(200 nM)誘導的衰老第0天和第3天的BJ-BRAF細胞在一定時間間隔里的表達。m.過表達SCAT7的BJ-BRAF細胞用MTT法測定細胞增殖。n,o,p,q.檢測接受他莫西芬治療3天后的陽性衰老細胞的百分比并p16、p15(o)和IL8 (p)的表達。
6. SCAT7調控FGF/FGFR, PI3K/AKT, and Ras/MAPK等多種信號通路。
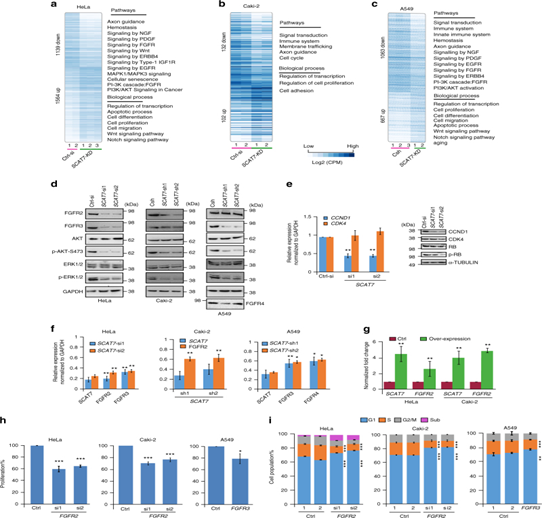
圖6:SCAT7通過FGF信號通路調控細胞周期進展和細胞增殖。a – c,d.在HeLa (a)、Caki-2 (b)和A549 (c)細胞系中敲低SCAT7后,通過熱圖揭示了在相應分子通路和生物過程的上調和下調基因。Western blot檢測蛋白水平。e.實時熒光定量qPCR(左面板)和Western blot(右面板)檢測到CCND1的表達水平顯著降低。f.qPCR驗證分別利用siRNAs或shRNA敲低的SCAT7及其靶基因的表達水平,g.過表達SCAT7檢測SCAT7及其靶基因FGFR2在HeLa和Caki-2細胞中的表達。h,iFGFR3沉默后進行MTT細胞增殖檢測并檢測細胞周期表達譜。
7. SCAT7/hnRNPK/YBX1復合體調控腫瘤標志物
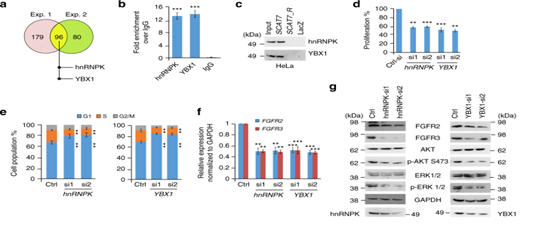
圖7:SCAT7與hnRNPK和YBX1互作,調控細胞增殖和細胞周期進程。a.維恩圖對HeLa細胞中的SCAT7相互作用的蛋白的交叉分析。b. RNA免疫印跡實驗(RIP)后qPCR檢測SCAT7。c.免疫印跡驗證SCAT7與hnRNPK和YBX1的相互作用。d.轉染兩個靶向hnRNPK或YBX1的siRNA后進行細胞周期分析。e,f.檢測FGFR2在敲低hnRNPK和YBX1的HeLa細胞中的表達。g.Western blot檢測hnRNPK和YBX1沉默的HeLa細胞中標志物的表達。
8. SCAT7是腫瘤的潛在治療靶點
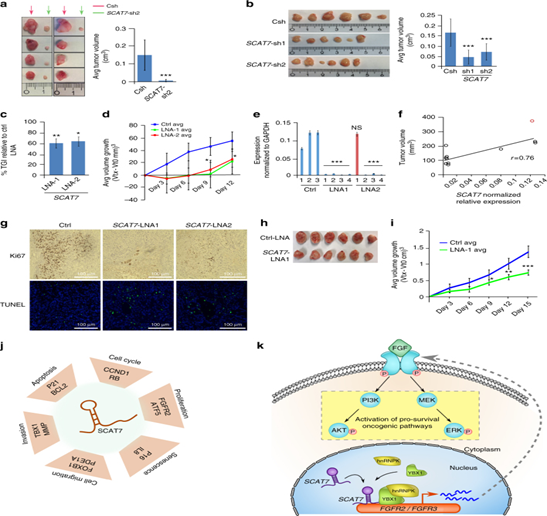
圖8:SCAT7是不同類型的腫瘤潛在治療靶點。a.在Balb / c裸鼠皮下注射1×106 Csh或SCAT7-sh2 786 - o細胞后8周檢測腫瘤生長狀況(每組n = 8)。b.在Balb / c裸鼠皮下注射1×106 Csh或SCAT7-sh1和SCAT7-sh2的 A549細胞8周后檢測腫瘤生長狀況(每組n = 6)。c.對Balb/c裸鼠進行4次皮下注射,檢測腫瘤生長抑制(TGI)作用(每組n = 5)。e. qPCR檢測Ctrl-LNA、SCAT7- LNA1、SCAT7- LNA2處理A549腫瘤后的表達SCAT7。f.散點圖揭示體內SCAT7的表達與腫瘤體積的相關性。h.對NSG小鼠進行人源腫瘤異體移植模型(PDX), i.用SCAT7 LNAs處理的PDX模型的平均腫瘤生長體積。j, k模型描述SCAT7 (k)在FGF/FGFR信號通路的調控機制。
參考文獻:Ali MM1, Akhade VS1, Kosalai ST1, Subhash S1, Statello L1, Meryet-Figuiere M1, Abrahamsson J2, Mondal T1, Kanduri C3. PAN-cancer analysis of S-phase enriched lncRNAs identifies oncogenic drivers and biomarkers. Nat Commun. 2018 Feb 28;9(1):883.






